
【题目】一定温度下将2 mol CO和2 mol H2O(g)充入2.0 L恒容绝热的密闭容器中,发生CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )
CO2(g)+H2(g) ΔH,正反应速率和时间的关系如下图所示。下列说法正确的是( )
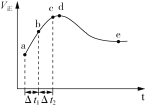
A.图中d点所示条件下,延长反应时间不能提高CO的转化率
B.反应器中的压强不变,说明反应已经达到平衡状态
C.Δt1=Δt2时,反应物的转化率:b~c段小于a~b段
D.e点CO的转化率为80%,则该温度下平衡常数为K=16
【答案】BD
【解析】
A. 根据图示可知:开始发生反应后,气体反应速率加快,说明该反应的正反应为放热反应,由于反应是在恒容绝热的密闭容器中进行,d点后正反应速率逐渐降低,说明d点反应达到平衡状态,后延长反应时间,反应正反应速率降低,则反应物浓度减小,化学平衡状态正向移动,时CO的转化率提高,A错误;
B. 该反应是反应前后气体体积不变的反应,反应是在恒容绝热的密闭容器中进行的,若反应器中的压强不变,说明反应温度不变,此时反应已经达到平衡状态,B正确;
C. 反应速率越快,相同时间内反应物转化为生成物的就更多,反应物的转化率越大,由于反应速率:b~c段>a~b段,所以反应物的转化率:b~c段大于a~b段,这与相同时间段内速率改变量大小无关,C错误;
D. 反应开始时c(CO)=c(H2O)=1 mol/L,c(CO2)=c(H2)=0,e点CO的转化率为80%,则该温度下平衡时c(CO)=c(H2O)=0.2 mol/L,c(CO2)=c(H2)=0.8 mol/L,根据平衡常数的含义可知平衡常数为K=![]() =16,D正确;
=16,D正确;
故合理选项是BD。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】联氨(N2H4)和次磷酸钠(NaH2PO2)都具有强还原性.都有着广泛的用途。
(1)已知:①N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-621.5 kJ●mol-1
②N2O4(l)-=N2(g)+2O2(g) △H2=+204.3 kJ●mol-1
则火箭燃料的燃烧反应为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H=_____.
(2)已知反应N2H4(g)+ 2Cl2(g)![]() N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
N2(g)+4HCl(g),T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ,测得Cl2和HCl的浓度随时间的关系如图所示。
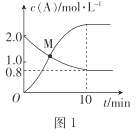
①0~ 10 min内,用N2(g)表示的平均反应速率v(N2)=_______。
②M点时,N2H4的转化率为______(精确到0.1)%。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g)、0.4 mol Cl2(g)、0. 8 mol N2 (g)、1.2 mol HCl(g) ,此时平衡______(填“正向移动”“逆向移动”或“不移动”)。
(3)①在惰性气体中,将黄磷(P4)与石灰乳和碳酸钠溶液一同加入高速乳化反应器中制得NaH2PO2,同时还产生磷化氢(PH3)气体,该反应的化学方程式为________________。
②次磷酸(H3PO2)是一元酸,常温下.1.0 mol●L-1的NaH2PO2溶液pH为8,则次磷酸的Ka=___________。
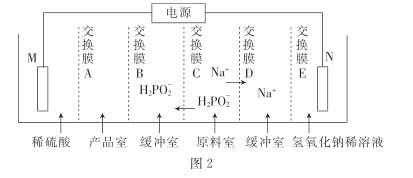
③用次磷酸钠通过电渗析法制备次磷酸.装置如图2所示。交换膜A属于____(填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为______,当电路中流过3.8528×105库仑电量时.制得次磷酸的物质的量为_____ (一个电子的电量为 1.6×10- 19库仑,NA数值约为6. 02× 1023)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,如图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓。如图②是电解法除去工业废水中的Cr2O72-,下列说法正确的是( )
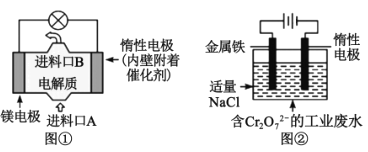
A.图①中镁电极发生的反应是:ClO-+H2O+2e-=Cl-+2OH-
B.图②最终得到Fe(OH)3和Cr(OH)3,则阳极上的电极反应式为:Fe-3e-=Fe3+
C.图②中每转移0.2mol电子,阴极逸出2.24LH2
D.若图①中7.2gMg溶解产生的电量用于图②废水处理,理论得到Fe(OH)3的物质的量为0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸在生活中应用广泛,H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,a、c为阳离子交换膜,且H+可B(OH)4-与反应生成H3BO3,下列叙述错误的是( )
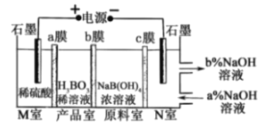
A. M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B. N室中:a%<b%
C. b膜为阴离子交换膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaClO(aq)![]() HClO(aq)
HClO(aq)![]() Cl2(g)
Cl2(g)
B.Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
C.Cu(s)![]() Cu2O(s)
Cu2O(s)![]() CuSO4(aq)
CuSO4(aq)
D.S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g) +B(g)![]() 2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )
2C(g),2 s后测得C的浓度为0.6 mol·L-1,下列说法正确的是( )
A. 用物质A表示的反应平均速率为0.6 mol·L-1·s-1
B. 用物质B表示的反应的平均速率为0.3 mol·L-1·s-1
C. 2s时物质A的转化率为30%
D. 2s时物质B的浓度为0.8mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100 mol·L-1 NaOH溶液滴定10 mL 0.100 mol·L-1 H3PO4溶液,曲线如图所示。下列说法正确的是
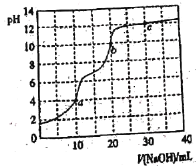
A.滴定终点a可选择酚酞作指示剂
B.c点溶液中c(Na+)>3c(PO43-)+2c(HPO42-)+c(H2PO4-)
C.b点溶液中c(HPO42-)>c(PO43-)>c(H2PO4-)
D.a、b、c三点中水的电离程度最小的是c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com