
 (1)CH3OH是一种可燃性的液体.已知3.2gCH3OH充分燃烧生成水蒸气时放热akJ,H2O(g)=H2O(l),△H=-bKJ•mol-1则表示CH3OH的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol(反应热用含a、b的代数式表示,a、b均大于0)
(1)CH3OH是一种可燃性的液体.已知3.2gCH3OH充分燃烧生成水蒸气时放热akJ,H2O(g)=H2O(l),△H=-bKJ•mol-1则表示CH3OH的燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol(反应热用含a、b的代数式表示,a、b均大于0)分析 (1)3.2gCH3OH为0.1mol,则1mol甲醇燃烧生成水蒸气放出10akJ,结合盖斯定律计算该题;
(2)燃料电池中燃料在负极失电子发生氧化反应,碱溶液中生成碳酸钾,氧气在正极得到电子生成氢氧根离子;
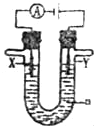
(3)石墨作电极电解硫酸铜溶液,Y是阳极,阳极上OH-失电子生成O2和H2O;X、Y分别是石墨、Cu,Cu作阳极,电解硫酸铜溶液,阳极上Cu失电子发生氧化反应,阴极上铜离子得电子发生还原反应,根据转移电子守恒计算消耗空气体积.
解答 解:(1)3.2gCH3OH为0.1mol,则1mol甲醇燃烧生成水蒸气放出10akJ,又H2O(g)=H2O(l),△H=-bKJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-(10a+2b)kJ/mol;
(2)甲醇-空气燃料电池中燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,氧气在正极得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
(3)石墨作电极电解硫酸铜溶液,X为阴极,Y是阳极,阳极上Cu失电子生成Cu2+,电极反应式为Cu-2e-=Cu2+,
若X、Y分别为石墨和铜,a为CuSO4溶液,电解硫酸铜溶液时,铜电极上铜失电子发生氧化反应,当铜片的质量变化12.8g,失去电子的物质的量=$\frac{12.8g}{64g/mol}$×2=0.4mol,
1mol氧气生成-2价氧元素得到4mol电子,则需要空气的体积=$\frac{0.4mol}{4}$×22.4L/mol÷20%÷20%=11.2L,
故答案为:阴;Cu-2e-=Cu2+;11.2.
点评 本题考查较综合,涉及电解原理、盖斯定律等知识点,为高频考点,明确化学反应原理及基本计算方法是解本题关键,难点是电极反应式的书写,注意转移电子守恒的灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
 在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )
在一定条件下,在容积不变的密闭容器内进行反应:2NO+2CO?N2+2CO2 △H<0.曲线a表示NO的转化率与反应时间的关系,若改变初始条件,使反应过程按照曲线b进行,可采取的措施是( )| A. | 加催化剂 | B. | 降低温度 | C. | 增大NO的浓度 | D. | 缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱、液态氧、碘酒、稀盐酸依次是盐、单质、混合物、电解质 | |
| B. | 干冰、生石灰、硫酸、碳酸氢铵依次是单质、氧化物、酸、盐 | |
| C. | 氯化氢、氨气、水银、草木灰依次是电解质、非电解质、单质、混合物 | |
| D. | 冰水、空气、泥水依次是溶液、胶体、浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2 和NO | B. | 肯定有SO2和NO2 | ||
| C. | 可能有Cl2、NO和O2 | D. | 肯定有SO2、NO和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | W的最高价氧化物对应水化物的酸性强于Z的最高价氧化物对应水化物的酸性 | |
| C. | X与Z形成的简单化合物比X与W形成的简单化合物稳定 | |
| D. | X与Y形成的化合物一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AgNO3溶液中加入Cu粉:Cu+Ag+═Cu2++2Ag | |
| B. | 向CaCl2溶液中通入CO2:Ca2++CO2═CaCO3↓+2H+ | |
| C. | 饱和FeCl溶液滴入沸水中制Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| D. | CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
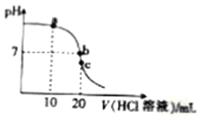
| A. | a点对应的溶液中,c(Cl-)>c(NH4+ )>c(OH- )>c(H+ ) | |
| B. | b点对应的溶液中,c(NH4+)>c(Cl-),c(OH- )=c(H+ ) | |
| C. | c点对应的溶液中,c(H+)=c(NH3•H2O)+c(OH- ) | |
| D. | 滴定过程中可能出现:c(NH4+ )>c(OH- )>c(H+ )>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物 | |
| B. | 由一种元素组成的物质一定是单质,两种元素组成的物质一定是化合物 | |
| C. | 非金属氧化物不一定是酸性氧化物,酸性氧化物不一定都是非金属氧化物 | |
| D. | 硫酸、纯碱、石膏是按酸、碱、盐排列的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com