
【题目】醇脱水是制备烯烃的常用方法,实验室制备环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
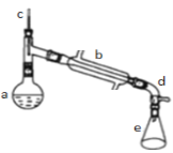
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.反应粗产物倒入f容器中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯.回答下列问题:
(1)由环己醇制取环己烯的方程式_________________;
(2)装置b的冷凝水方向是________________(填“下进上出”或“上进下出”);
(3)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是___(选答案);
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称及反应类型为_____、____;
(5)在分离提纯中,使用到的仪器f名称是___________;
(6)合成过程中加入浓硫酸的作用是_________;
【答案】![]() 下进上出 B 醚键 取代反应 分液漏斗 催化剂、脱水剂
下进上出 B 醚键 取代反应 分液漏斗 催化剂、脱水剂
【解析】
(1)环己醇在浓硫酸、加热条件下发生消去反应生成环己烯;
(2)冷凝管采用逆向通水,冷凝效果好;
(3)补加碎瓷片时需要待已加热的试液冷却后再加入;
(4)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应生成二环己醚;
(5)环己烯不溶于水,可通过分液操作分离;
(6)浓硫酸在环己烯的制取过程中起到了催化剂和脱水剂的作用。
(1)在浓硫酸存在条件下,加热环己醇可制取环己烯,反应的化学方程式为:![]() ,
,
因此,本题正确答案是:![]() ;
;
(2)蒸馏操作中,冷凝管采用逆向通水,即下进上出通水,冷凝效果较好,
因此,本题正确答案是:下进上出;
(3)补加碎瓷片时需要待已加热的试液冷却后再加入,
因此,本题正确答案是:B;
(4)加热过程中,环己醇除可发生消去反应生成环己烯外,还可以发生取代反应,分子间发生脱水反应生成二环己醚,副产物的结构简式为 ![]() ,含有的官能团为醚键,
,含有的官能团为醚键,
因此,本题正确答案是:醚键;取代反应;
(5)环己烯难溶于水,可通过分液操作分离,使用的仪器为分液漏斗;
因此,本题正确答案是:分液漏斗;
(6)在反应 ![]() 中,浓硫酸起到了催化剂和脱水剂的作用,
中,浓硫酸起到了催化剂和脱水剂的作用,
因此,本题正确答案是:催化剂、脱水剂。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸。
(1)写出亚硝酸的电离方程式___;
(2)酸性条件下,NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2,则产物中含氮物质的化学式为__;
(3)请你设计一个实验方案鉴别氯化钠和亚硝酸钠(提示AgNO2呈白色,在溶液中以沉淀形式存在)___;
(4)工业废水中NO2-可用铝粉除去,产生无毒无味的气体。若反应过程中转移6mol电子,则生成该气体在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉事件曾一度震惊全国,主要是奶粉中含有有毒的三聚氰胺。下列关于三聚氰胺分子的说法中正确的是( )
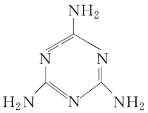
A. 所有氮原子均采取sp3杂化
B. 一个三聚氰胺分子中共含有15个σ键
C. 三聚氰胺的分子式为C3N3H6
D. 三聚氰胺分子中同时含有极性键和非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A最早发现于酸牛奶中,它是人体糖代谢的中间体,可由玉米淀粉发酵制得,其盐是人们喜爱的补钙制剂之一。A在铜的催化作用下可发生氧化反应,其氧化产物不能发生银镜反应。在浓硫酸的作用下,A可发生如下反应

试回答下列问题:
(1)写出下列物质的结构简式:A________ F________
(2)A→B的反应类型________
(3)写出下列反应的化学方程式:
A→E______________________
A→D_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锥形瓶内盛有气体X,滴管内盛有液体Y。若挤压胶头滴管,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起。气体X和液体Y不可能是( )
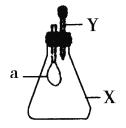
A.X是NH3,Y是水
B.X是SO2,Y是NaOH浓溶液
C.X是CO2,Y是稀硫酸
D.X是HCl,Y是NaNO3稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长期缺碘和碘摄入过量都会对健康造成危害,目前加碘食盐中碘元素绝大部分以IO3-存在,少量以I-存在。现使用Na2S2O3对某碘盐样品中碘元素的含量进行测定。
I.I-的定性检测
(1)取少量碘盐样品于试管中,加水溶解。滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液。若溶液变色,则存在I-,同时产生的无色气体产生遇空气变为红棕色,试写出该反应的离子方程式为_____________。
Ⅱ.硫代硫酸钠的制备
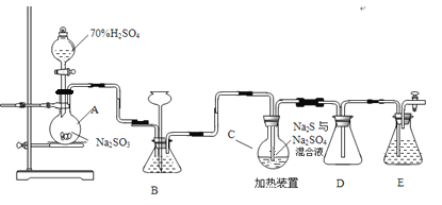
化学实验室可用如下装置(略去部分加持仪器)制备Na2S2O35H2O。烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)![]() Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若_____________,则整个装置气密性良好。装置D的作用是_____________ 。装置E中为_____________溶液。
(3)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为_____________。
(4)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择____________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是_____________。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象__________________。
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作____________,现象和结论_________:。
已知Na2S2O35H2O遇酸易分解:S2O32+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
Ⅲ.碘含量的测定
巳知:①称取10.00g碘盐样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为:I-+3Br2+3H2O = IO3-+6H++6Br-,IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32-= 2I-+S4O62-
(6)请根据上述数据计算该碘盐含碘量为_______________mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
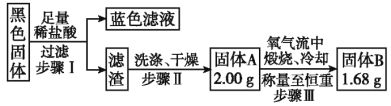
【题目】某研究性学习小组设计如下实验装置进行探究。
⑴装置A中反应的化学方程式为____________。

⑵实验结束后,欲验证反应生成的气体具有还原性,小组同学取装置B中溶液少量于一洁净的试管中,应向试管中加入的试剂是___。(填字母)。
a.品红溶液 b.稀盐酸 c.BaCl2溶液 d.稀硝酸
⑶实验结束,小组同学立即熄灭酒精灯,可能导致的后果是______________。
⑷实验结束,发现在铜片表面附着黑色固体。查阅资料得知此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为CuO和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:
①步骤Ⅱ中检验滤渣是否洗涤干净的实验方法是_______________。
②黑色固体的成分是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m、n、x、y四种主族元素在周期表里的相对位置如下图所示。已知它们的原子序数总和为46,则:

(1)元素n的气态氢化物的分子式为_____________ ,空间构型为_____________。
(2)m与y所形成的化合物含_________ 键,属_________ 分子。(填“极性”或“非极性”)
(3)x位于周期表中的位置是______;与其最高价含氧酸根离子互为等电子体的分子是_____________(写一种)。
(4)由n、y的氢化物相互作用所生成的物质在固态时属于_________晶体,y的某种含氧酸钠盐显碱性,其原因为_______________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下反应:A2(气)+B2(气)![]() 2AB(气)达平衡状态的标志是( )
2AB(气)达平衡状态的标志是( )
A.单位时间内生成n摩A2,同时生成n摩AB
B.单位时间内生成n摩B2,同时生成2n摩AB
C.单位时间内生成n摩A2,同时生成n摩B2
D.容器内总物质的量不变(或总压不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com