
���� �л���������ܶ���������38��������Է�������Ϊ38��2=76��15.2g�л���A�����ʵ���Ϊ$\frac{15.2g}{76g/mol}$=0.2mol�������ɵ�����ͨ��Ũ���ᣬŨ��������14.4g��ʣ��������ͨ����ʯ�ң���ʯ������26.4g����֪n��H2O��=$\frac{14.4g}{18g/mol}$=0.8mol��n��CO2��=$\frac{26.4g}{44g/mol}$=0.6mol�����л�����N��C��=$\frac{0.6}{0.2}$=3��N��H��=$\frac{0.8}{0.2}$��2=8�������Է�������ȷ��Oԭ�Ӹ�������ȷ���л������ʽ��A�ĺ˴Ź�����������ʾ�������壬�����֮��Ϊ2��1��1����ȷ���л���ṹ��ʽ���жϿ��ܾ��е����ʣ��Դ˽����⣮
��� �⣺��1���л���������ܶ���������38��������Է�������Ϊ38��2=76��15.2g�л���A�����ʵ���Ϊ$\frac{15.2g}{76g/mol}$=0.2mol�������ɵ�����ͨ��Ũ���ᣬŨ��������14.4g��ʣ��������ͨ����ʯ�ң���ʯ������26.4g����֪n��H2O��=$\frac{14.4g}{18g/mol}$=0.8mol��n��CO2��=$\frac{26.4g}{44g/mol}$=0.6mol�����л�����N��C��=$\frac{0.6}{0.2}$=3��N��H��=$\frac{0.8}{0.2}$��2=8����֪N��O��=$\frac{76-3��12-8}{16}$=2�������ʽΪC3H8O2��
���л���ķ���ʽΪC3H8O2��
��2��A�����Ը��������Һ�������£����ձ��B��1molB��̼��������Һ��Ӧ����2mol���壬˵��B����2���Ȼ�����BΪHOOCCH2COOH����AΪHOCH2CH2CH2OH��
��A�ṹ��ʽΪHOCH2CH2CH2OH��
��3��AΪHOCH2CH2CH2OH��BΪHOOCCH2COOH�����߷������۷�Ӧ���ɸ߷��ӻ������ѧ����ʽΪnHOCH2CH2CH2OH+nHOOCCH2COOH��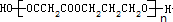 +��2n-1��H2O��
+��2n-1��H2O��
����B���ɸ߷��ӻ�����Ļ�ѧ����ʽΪnHOCH2CH2CH2OH+nHOOCCH2COOH��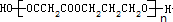 +��2n-1��H2O��
+��2n-1��H2O��
���� ���⿼���л�����ƶϣ�Ϊ��Ƶ���㣬���ؿ���ѧ���ķ��������������������ؼ��Ǽ���ȷ��A�ķ���ʽ���������չ����ŵ�������ת��������ṹ�����ʵĹ�ϵ���Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ȥ��12���ҹ���������ġ����úš����������������ҹ�����Ƽ���ʵ�������ϰ�װ��̫���ܵ�ط���IJ����Ƕ������� | |
| B�� | ˮ��ұ���ø�ѹ���ȥ�����̳��������˽�������� | |
| C�� | �й�ʳƷ�����ල�ֹ涨����2011��5�·�������н�ֹ����CaO2�����������������������ɴ�˵�����Ӽ���������Σ�����彡�� | |
| D�� | ��úΪȼ�ϵĹ���������β���ŷ���������������������������õİ취�������������֣���ȷ���ΰ��ķ����ʽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ӻ�ˮ�п���ȡʳ�� | B�� | ��ˮ����ɵõ�ˮ | ||
| C�� | ֱ�ӵ�⺣ˮ�ɵ�þ | D�� | �Ӻ�ˮ�п���ȡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | I-��Br-��Cl- | B�� | Br-��Cl-��I- | C�� | Cl-��I-��Br- | D�� | Br-��I-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij�������ӵĺ�������Ų�Ϊ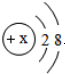 �������һ������ԭ�� �������һ������ԭ�� | |
| B�� | ԭ�������ֻ��1�����ӵ�Ԫ��һ���ǽ���Ԫ�� | |
| C�� | NH4+��H3O+������ͬ���������͵����� | |
| D�� | �����������Ǵ���������2����ԭ������ʧȥ���ӳ�Ϊ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 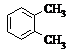 �� ��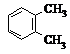 | B�� | 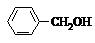 �� �� 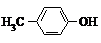 | C�� |  �� ��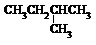 | D�� | 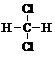 �� �� 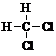 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
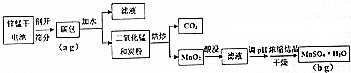
| ������� | Ũ�� | п�Ľ�ȡ��/% | �̵Ľ�ȡ��/% |
| ���� | 1��1 | 96.2 | 95.1 |
| ���� | 1��1 | 95.1 | 94.6 |
| ���� | 1��1 | 94.5 | 94.7 |
| ���� | 1��1 | 58.4 | 42.3 |
| Ũ�� | п�Ľ�ȡ��/% | �̵Ľ�ȡ��/% |
| 1��1 | 96.2 | 95.1 |
| 1��2 | 90.4 | 88.5 |
| 1��3 | 87.3 | 82.4 |
| Mn��OH��2 | Al��OH��3 | |||||
| ��ʼ���� | ��ȫ���� | ��ʼ���� | ��ȫ���� | ��ʼ�ܽ� | ��ȫ�ܽ� | |
| PH | 8.2 | 9.8 | 3.7 | 5.2 | 7.8 | 10.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a c f h | B�� | a c e g | C�� | a c e f h | D�� | b d e h |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com