
| A.若为盐酸,pH减小 | B.若为氢氧化钠溶液,pH减小 |
| C.若为硫酸钠溶液,pH不变 | D.若为氯化钠溶液,pH不变 |
科目:高中化学 来源:不详 题型:单选题
| A.45mL | B.50mL | C.75mL | D.100mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
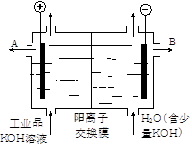
| A.该电解槽的阳极反应式是4OH--2e-→2H2O+ O2↑ |
| B.通电开始后,阴极附近溶液pH会减小 |
| C.除去杂质后氢氧化钾溶液从液体出口A导出 |
| D.用氯化钾制备氢氧化钾也可采用这种离子交换膜电解法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
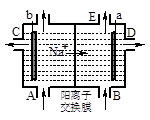
A.a极的电极反应式为:2 H++ 2 e H2 ↑ H2 ↑ |
| B.D口导出的是NaOH溶液 |
| C.浓盐水从A口注入 |
| D.C口导出的是NaOH和NaCl的混合溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

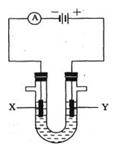
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
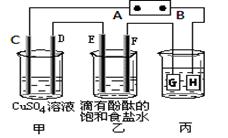
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
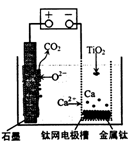
| A.将熔融CaF2-CaO换成Ca(NO3)2溶液也可以达到相同目的 |
B.阳极的电极反应式为:C+2O2--4e- CO2↑ CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+"接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
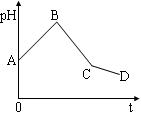
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+,故pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳极发生还原反应,其电极反应式:Ni2++2e-= Ni |
| B.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| C.电解过程中,阳极质量的减少与阴极质量的增加不相等 |
| D.电解后,电解槽底部的阳极泥中只有Pt |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com