
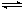 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
科目:高中化学 来源:不详 题型:单选题
| A.加入碳酸钠固体 | B.改用18 mol/L的浓H2SO4 |
| C.滴入少量硫酸铜溶液 | D.加入硫酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

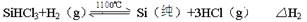
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
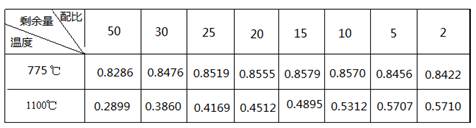
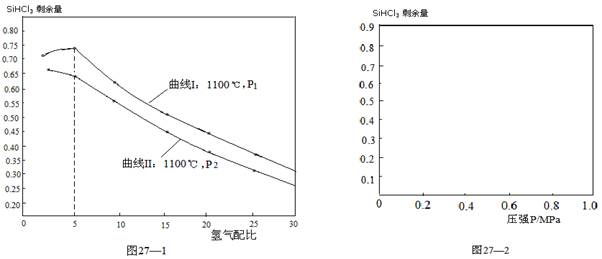
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
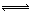 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)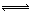 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)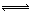 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
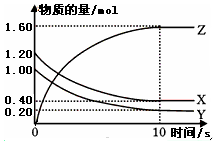
 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
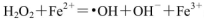
 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
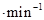
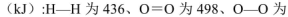
 .
.查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
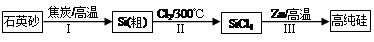
 Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0 Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0 Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:| 时间/浓度 | c(NH3)( mol·L-1) | c(O2)( mol·L-1) | c(NO)( mol·L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
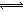 HOI(aq) △H2
HOI(aq) △H2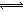 I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3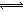 I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。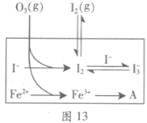
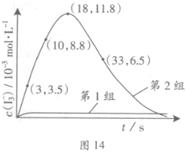
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+ I- | 5.2 | 11.0 |
| 第2组 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com