
| A. | 26 g | B. | 28 g | C. | 29.5 g | D. | 29.1 g |
分析 Fe、Mg混合物与足量硝酸反应形成硝酸镁、铁的硝酸盐,金属完全溶解,再加入足量的氢氧化钠溶液,生成沉淀为氢氧化镁、氢氧化铁,根据电荷守恒可知,金属提供的电子物质的量与氢氧化物中氢氧根的物质的量相等,根据电子转移守恒计算金属提供的电子物质的量,氢氧化物沉淀的质量为金属质量与氢氧根质量之和.
解答 解:Fe、Mg混合物与硝酸反应形成硝酸镁、铁的硝酸盐,金属完全溶解,再加入足量的氢氧化钠溶液,生成沉淀为氢氧化镁、氢氧化铁,
根据电子转移守恒可知,金属提供的电子物质的量=0.3mol×(5-2)=0.9mol,
根据电荷守恒可知,金属提供的电子物质的量与氢氧化物中氢氧根的物质的量相等,故n(OH-)=0.9mol,
所以所得沉淀的质量=m(金属)+m(OH-)=13.8g+0.9mol×17g/mol=29.1g,
故选D.
点评 本题考查混合物的计算,题目难度中等,侧重对解题方法技巧与守恒思想的考查,确定氢氧化物中氢氧根的物质的量是关键,试题培养了学生的分析能力及化学计算能力.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:选择题
| A. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | |
| B. | K2Cr2O7+6FeSO4+7H2SO4═Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O | |
| C. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | |
| D. | 2KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | Br2+2NaI═I2+2NaBr | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同浓度和体积的强碱和强酸溶液混合后,溶液的pH一定等于7 | |
| B. | 在NaHCO3溶液中,c(CO32-)>c(HCO3-) | |
| C. | 在有AgCl沉淀的溶液中加入NaCl固体,c(Ag+)减小 | |
| D. | 将pH相等的CH3COONa和NaOH溶液稀释相同倍数,CH3COONa溶液的pH较小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠投入到CuSO4溶液中:2Na+Cu2+═Cu↓+2Na+ | |
| B. | 澄清石灰水中加过量小苏打:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 氢氧化铝中滴入足量盐酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | 四氧化三铁粉末投入到足量盐酸中:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
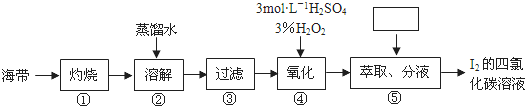
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe 3O4 | |
| B. | Al(OH)3胶体在酸或碱溶液里都能溶解 | |
| C. | 除去FeCl2溶液中的FeCl3杂质,可以向溶液中加入过量铁粉,然后过滤 | |
| D. | Fe3+与KSCN产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
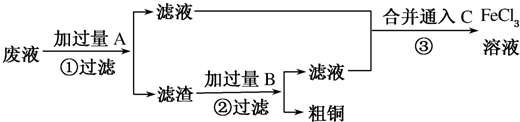
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com