
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=1的溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
分析 A.使酚酞试液变红的溶液,显碱性;
B.由水电离的c(H+)=10-12 mol•L-1的溶液,为酸或碱溶液;
C.pH=1的溶液,显酸性;
D.离子之间发生氧化还原反应.
解答 解:A.使酚酞试液变红的溶液中OH- 与Fe3+ 生成红褐色沉淀,不能共存,故A错误;
B.由水电离的c(H+)=10-12 mol•L-1的溶液,可能是酸性,也可能是碱性,均可以大量共存,故B正确;
C.pH=1的溶液呈酸性,该组离子之间不反应,可以大量共存,故C正确;
D.有NO3-存在的强酸性溶液中,发生3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,不能共存,故D错误;
故选BC.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应的判断,题目难度不大.


科目:高中化学 来源: 题型:推断题
 →
→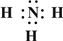 ,B的结构式为
,B的结构式为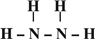 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
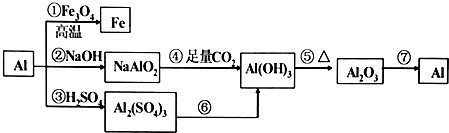
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难失电子的原子,获得电子的能力一定强 | |
| B. | 易得电子的原子所形成的简单阴离子,其还原性一定强 | |
| C. | 活泼金属与活泼非金属化合,易形成离子键 | |
| D. | 电子层结构相同的不同离子,核电荷数越多,半径越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温结构陶瓷属于新型无机非金属材料,可以作为高级耐火材料 | |
| B. | 氧化铝陶瓷属于新型无机非金属材料,它是生物陶瓷 | |
| C. | 氮化硅陶瓷属于新型无机非金属材料,可用于制造陶瓷发动机的受热面 | |
| D. | 新型无机非金属材料克服了传统无机非金属材料的缺点,但是强度比较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
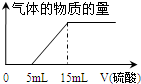 某化学兴趣小组用100mL 1mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化).为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验.请帮助他们完成下列相应实验内容.
某化学兴趣小组用100mL 1mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化).为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验.请帮助他们完成下列相应实验内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=12的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com