
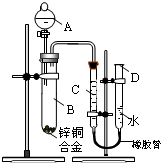
 某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.| a-b |
| a |
| a-b |
| a |


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
教材中有一个演示实验:用脱脂棉包住约0.2 g Na![]() O
O![]() 粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
粉末,置于石棉网上,可观察到脱脂棉燃烧起来。
(1)由实验现象能得出的有关Na![]() O
O![]() 与水反应的结论是:a.有氧气生成;b.____________。
与水反应的结论是:a.有氧气生成;b.____________。
(2)某研究性学习小组拟用如右图所示装置进行实验,以证明上述结论。
①用以验证结论a的实验方法及现象是____________________________。
②用以验证结论b的实验方法及现象是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组用如右图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。

(1)A中试剂为__________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是__________(填序号);记录C的液面位置时,除视线平视外,还应__________。
(4)B中发生反应的化学方程式为____________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g?,则铝的相对原子质量为__________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得的质量分数将__________(填“偏大”“偏小”或“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com