
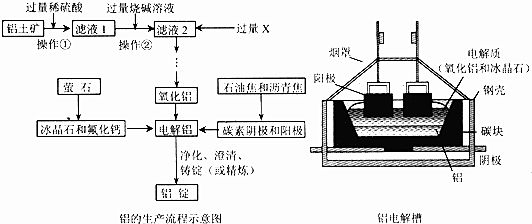
分析 铝土矿(主要成分为Al2O3、Fe2O3、SiO2等),加入过量稀硫酸,氧化铝、氧化铁溶解,二氧化硅不溶,过滤得到滤液1是氯化铝溶液、氯化铁溶液,加入过量氢氧化钠溶液发生反应生成氢氧化铁沉淀、偏铝酸钠溶液,过滤得到滤液2为偏铝酸钠溶液,通入过量的X为二氧化碳反应生成碳酸氢钠、氢氧化铝沉淀,过滤得到氢氧化铝沉淀受热分解生成氧化铝,通过加入冰晶石恒容氟化钙降低氧化铝熔点,以碳素做阴阳极,电解生成电解铝,净化、澄清、精炼得到铝锭,
(1)分析可知操作1和操作2是分离固体和溶液的操作为过滤,加入过量氢氧化钠溶液是铁离子生成氢氧化铁沉淀,铝离子和过量氢氧化钠反应生成偏铝酸钠和水;
(2)加入过量X为二氧化碳,二氧化碳和偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸氢钠;
(3)电解原理可知阳极失氧化铝熔融后电离出的氧离子失电子生成氧气发生氧化反应,实际生产中阳极需要定期更换是因为阳极上生成氧气会和材料中碳发生反应消耗电极;
(4)依据电解原理分析可知,在电解槽的钢板和阴极碳素材料之间需要耐火绝缘;
(5)Al为活泼金属,电解铝时的电解质为氧化铝-冰晶石熔融液,常加入少量氯化钙的目的是降低熔点,Al2O3的熔点很高,熔化需要较多能量,加入冰晶石可以降低Al2O3的熔化温度.根据质量守恒定律书写该化学方程式;
(6)某铝土矿中氧化铝的质量分数为51%,则1吨该铝土矿中氧化铝质量=1×106g,含铝物质的量=$\frac{1×1{0}^{6}g×51%}{102g/mol}$=10000mol,计算得到冶炼金属铝耗电能,已知每个铝制易拉罐约15g,其中铝的质量分数为90%,其中铝的物质的量=$\frac{15g×90%}{27g/mol}$=0.5mol,由一只易拉罐回收生产金属铝耗电能约4.5×104J,生产1molAl耗电能=4.5×104J×$\frac{1}{0.5}$=9×104J,制得等量金属铝的能耗和上述流程生产方法耗能之比计算得到,易拉罐的回收利用可以节约能源.
解答 解:铝土矿(主要成分为Al2O3、Fe2O3、SiO2等),加入过量稀硫酸,氧化铝、氧化铁溶解,二氧化硅不溶,过滤得到滤液1是氯化铝溶液、氯化铁溶液,加入过量氢氧化钠溶液发生反应生成氢氧化铁沉淀、偏铝酸钠溶液,过滤得到滤液2为偏铝酸钠溶液,通入过量的X为二氧化碳反应生成碳酸氢钠、氢氧化铝沉淀,过滤得到氢氧化铝沉淀受热分解生成氧化铝,通过加入冰晶石恒容氟化钙降低氧化铝熔点,以碳素做阴阳极,电解生成电解铝,净化、澄清、精炼得到铝锭,
(1)分析可知操作1和操作2是分离固体和溶液的操作为过滤,加入过量氢氧化钠溶液是铁离子生成氢氧化铁沉淀,铝离子和过量氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓,
故答案为:过滤;Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓;
(2)NaAlO2溶液中通入过量CO2生成Al(OH)3和NaHCO3,反应的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,
故答案为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;
(3)电解原理可知阳极失氧化铝熔融后电离出的氧离子失电子生成氧气发生氧化反应,电极反应为:2O2--4e-=O2↑,实际生产中阳极需要定期更换是因为阳极上生成氧气会和材料中碳发生反应消耗电极,
故答案为:2O2--4e-=O2↑;阳极产生的氧气会与电极材料中的碳反应而使阳极损耗;
(4)依据电解原理分析可知,在电解槽的钢板和阴极碳素材料之间需要耐火绝缘,故选a,
故答案为:a;
(5)Al2O3的熔点很高,熔化需要较多能量,电解铝时,以氧化铝-冰晶石溶融液为电解质,其中也常加入少量的氟化钙,氟化钙的作用是帮助降低Al2O3的熔化温度;工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,根据质量守恒定律书写该化学方程式为:2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
故答案为:帮助降低氧化铝的熔点;2Al(OH)3+12HF+3Na2CO3 =2Na3AlF6+3CO2+9H2O;
(6)某铝土矿中氧化铝的质量分数为51%,则1吨该铝土矿中氧化铝质量=1×106g,含铝物质的量=$\frac{1×1{0}^{6}g×51%}{102g/mol}$=10000mol,生产1mol金属铝耗电能约1.8×106J.则1吨该铝土矿冶炼金属铝耗电能=1.8×106J×10000=1.8×1010J,已知每个铝制易拉罐约15g,其中铝的质量分数为90%,其中铝的物质的量=$\frac{15g×90%}{27g/mol}$=0.5mol,由一只易拉罐回收生,产金属铝耗电能约4.5×104J,生产1molAl耗电能=4.5×104J×$\frac{1}{0.5}$=9×104J,制得等量金属铝的能耗为上述流程生产方法耗能的$\frac{9×1{0}^{4}}{1.8×1{0}^{6}}$=5,通过对计算数据的分析,易拉罐的回收利用可以节约能源,
故答案为:1.8×1010;5;易拉罐的回收利用有利于节约能源;
点评 本题考查了物质分离提纯的流程分析判断、电解原理和电极反应书写、元素守恒的计算等知识点,主要是铝及其化合物性质的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
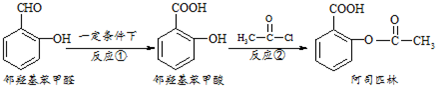
| A. | 与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3 种 | |
| B. | 用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① | |
| C. | 邻羟基苯甲醛不能和溴水发生取代反应 | |
| D. | 1mol阿司匹林最多可以和2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2是很好的抑菌剂,红酒中常加人微量的SO2 | |
| B. | 麦片中常加人微量铁粉,可以防止被氧化而变质 | |
| C. | “PM2.5“是指大气中直径≤2.5微米的颗粒物.其悬浮在空气中一定形成气溶胶 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
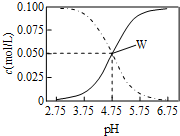 25℃时,在醋酸和醋酸钠混合溶液中有c(CH3COOH)+c(CH3COO-)=0.1mol/L且c(CH3COOH)、c(CH3COO-)与pH的关系如图.有关离子浓度叙述正确的是( )
25℃时,在醋酸和醋酸钠混合溶液中有c(CH3COOH)+c(CH3COO-)=0.1mol/L且c(CH3COOH)、c(CH3COO-)与pH的关系如图.有关离子浓度叙述正确的是( )| A. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol/L | |
| B. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 向W点所表示溶液中通入0.05mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
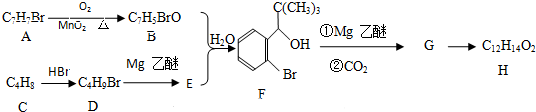
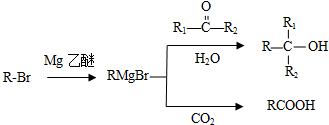
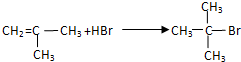 ;G→H
;G→H .
.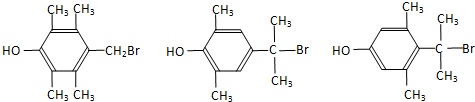 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
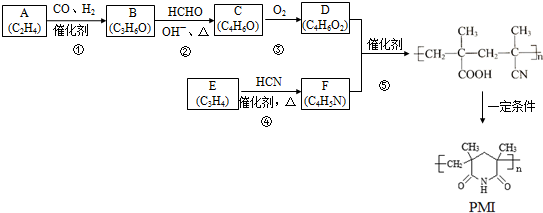
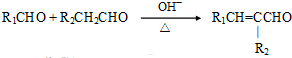 (注:R1可以是烃基本,也可以是H原子)
(注:R1可以是烃基本,也可以是H原子)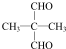 .
.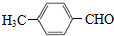 及其他物质为原料经如下步骤可合成对甲基苯丙烯酸甲酯:
及其他物质为原料经如下步骤可合成对甲基苯丙烯酸甲酯: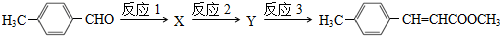
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com