
| A. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| B. | 石英可用于制电脑芯片 | |
| C. | 纯碱可用于治疗胃酸过多 | |
| D. | 过氧化钠可用作于潜艇的供氧剂 |
分析 A.四氧化三铁为黑色;
B.石英为二氧化硅,而Si为半导体材料;
C.纯碱的碱性太强;
D.过氧化钠与二氧化碳反应生成氧气.
解答 解:A.四氧化三铁为黑色,而氧化铁俗称铁红,可用于作油漆、红色涂料,故A错误;
B.石英为二氧化硅,而Si为半导体材料,则Si用于制电脑芯片,故B错误;
C.纯碱的碱性太强,应利用氢氧化铝或小苏打治疗胃酸过多,故C错误;
D.过氧化钠与二氧化碳反应生成氧气,则过氧化钠可用作于潜艇的供氧剂,故D正确;
故选D.
点评 本题考查物质的性质与用途,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 L H2O中分子的数目为0.1 NA | |
| B. | 0.1 mol•L-1 NH4Cl溶液中含有Cl-的数目为0.1 NA | |
| C. | 常温下,1.7 g NH3中含有原子数目为0.3 NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 再加入10 mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A. | 100 mL 0.1 mol/L盐酸 | 溶液中2c=c(Cl-) |
| B. | 0.01 mol Na2O2固体 | 反应完全后,溶液pH增大,c(Na+)=2c(Cl-) |
| C. | 100 mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D. | 100 mL 0.1 mol/L NH3•H2O | 溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
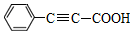 )广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )
)广泛用于医药、香料等化工产品中.下列关于苯丙炔酸的说法正确的是( )| A. | 分子式为C9H7O2 | |
| B. | 与丙炔酸(CH≡C-COOH)互为同系物 | |
| C. | 是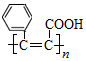 高分子化合物的单体 高分子化合物的单体 | |
| D. | 1 mol苯丙炔酸最多可与4mol氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
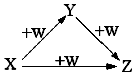 X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是 ( )
X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是 ( )| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
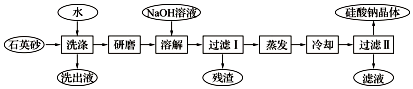
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | ||
| Y | Z |
| A. | Z元素的最高价氧化物水化物的酸性强于Y | |
| B. | 由W元素形成的分子W2中存在三个共价键 | |
| C. | 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定 | |
| D. | 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com