
【题目】一般用于检验Cl-的试剂是( )
A.BaCl2、稀硝酸B.稀硝酸 、AgNO3
C.稀盐酸、BaCl2D.AgNO3、稀盐酸
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是()
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子数目的多少有关
C.恰好完全反应时,溶液不易导电,所以BaSO4和水都是弱电解质
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,含氮元素的物质可发生如图所示的循环转化。

回答下列问题:
(1)氮的原子结构示意图为_________。
(2)图中属于“氮的固定”的是_________(填字母,下同);转化过程中发生非氧化还原反应的是_________。
(3)若“反应h”是在NO2与H2O的作用下实现,则该反应中氧化产物与还原产物的物质的量之比为_________。
(4)若“反应i”是在酸性条件下由NO3-与Zn的作用实现,则该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质且常温常压下为气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
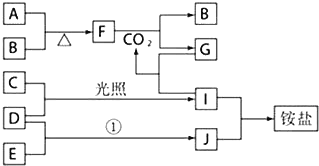
请按下列要求填空:
(1)CO2的电子式____.A的原子结构示意图________,
(2)化合物I的沸点比J的沸点____(填“高”或“低”),理由是 _________。
(3)化合物F中,阳离子与阴离子个数比是____。
(4)写出F和CO2反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol两种气态烃组成的混合气体完全燃烧后得到1.5 mol CO2和2 mol H2O。下列说法正确的是
A. 一定有乙烷 B. 一定有甲烷
C. 一定没有甲烷 D. 不一定有甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A.过滤时为加快速度,可先将上层清液注入过滤器中,再将沉淀转移到过滤器中
B.蒸发时用玻璃棒搅拌,是为了使析出的固体重新溶解
C.蒸馏时需从冷凝管上口进水,下口出水
D.分液时,下层液体放完后,再从下口放出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在科学史上每一次重大的发现都极大地推进了科学的发展。下列对化学史的描述正确的是
A. 侯德榜制的碱是NaOH B. 阿伏加德罗提出分子的概念
C. 道尔顿发现电子 D. 凯库勒的贡献在于制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com