
| m |
| M |
| n |
| V |
| 56g |
| 56g/mol |
| 142g |
| 35.5g/mol |
| 100mL |
| 1000mL |
| 0.4mol |
| 1L |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、新制氯水中只含C12和HClO分子 |
| B、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C、光照氯水有气泡冒出,该气体为Cl2 |
| D、氯水放置数天后,pH值将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、S2-的结构示意图: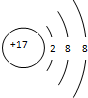 |
B、NaCl的电子式: |
| C、Cl2的结构式:Cl-Cl |
| D、NaHCO3的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
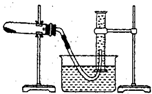
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 实验步骤 | 预期现象与结论 |
| 步骤I:取少量样品于一支试管中,向其中加入适量 ,塞上带导管的单孔塞,将导管另一端插入盛有足量 的试管中 | |
| 步骤II: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com