
·ÖĪö 2minÄ©·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³ÉĮĖ0.8molD£¬Ōņ×Ŗ»Æ0.8molA£¬æÉÖŖ
2A£Øg£©+B£Øg£©?C£Øg£©+2D£Øg£©
ĘšŹ¼£Ømol£©2 2 0 0
×Ŗ»Æ£Ømol£©0.8 0.4 0.4 0.8
Ę½ŗā£Ømol£©1.2 1.6 0.4 0.8
½įŗĻĻą¹Ų¼ĘĖć¹«Ź½¼ĘĖćĻą¹ŲĪļĄķĮ棬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗ2minÄ©·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³ÉĮĖ0.8molD£¬Ōņ×Ŗ»Æ0.8molA£¬æÉÖŖ
2A£Øg£©+B£Øg£©?C£Øg£©+2D£Øg£©
ĘšŹ¼£Ømol£©2 2 0 0
×Ŗ»Æ£Ømol£©0.8 0.4 0.4 0.8
Ę½ŗā£Ømol£©1.2 1.6 0.4 0.8
£Ø1£©“Ó·“Ó¦æŖŹ¼ÖĮ“ļµ½Ę½ŗā£¬ÓĆD±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/£ØL£®min£©£¬¹Ź“š°øĪŖ£ŗ0.2mol/£ØL£®min£©£»
£Ø2£©BµÄĘ½ŗāÅضČĪŖ$\frac{1.6mol}{2L}$=0.8mol/£ØL£®min£©£¬AµÄ×Ŗ»ÆĀŹĪŖ$\frac{0.8mol}{2mol}”Į100%$=40%£¬¹Ź“š°øĪŖ£ŗ0.8mol/£ØL£®min£©£»40%£»
£Ø3£©ĖõŠ”Ģå»ż£¬Ń¹ĒæŌö“ó£¬Ę½ŗā²»ŅĘ¶Æ£¬ĘųĢåµÄĆܶČŌö“󣬵«Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä£¬¹Ź“š°øĪŖ£ŗŌö“ó£»²»±ä£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éę¼°»Æѧ·“Ó¦ĖŁĀŹ”¢»ÆŃ§Ę½ŗāŅĘ¶Æ”¢»ÆŃ§Ę½ŗā¼ĘĖćµČ£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦”¢¼ĘĖćÄÜĮ¦µÄ漲飬ÄѶČÖŠµČ£¬×¢Ņā»ł“”ÖŖŹ¶µÄÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | aĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæŅ»¶Ø±ČbĘųĢåµÄĻą¶Ō·Ö×ÓÖŹĮæ“ó | |
| B£® | aĘųĢåæÉÄÜŹĒCO£¬bĘųĢåæÉÄÜŹĒCH4 | |
| C£® | AĘųĒņÖŠĖłŗ¬ĘųĢå·Ö×ÓŹż“óÓŚBĘųĒņÖŠĖłŗ¬ĘųĢå·Ö×ÓŹż | |
| D£® | ³äĘųŗó£¬AĘųĒņµÄÖŹĮæŅ»¶Ø“óÓŚBĘųĒņµÄÖŹĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
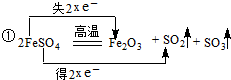 £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
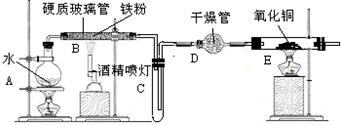
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
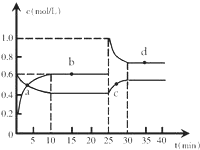 ŌŚŗćĪĀŗćČŻĢõ¼žĻĀ£¬½«Ņ»¶ØĮæNO2ŗĶN2O4µÄ»ģŗĻĘųĢåĶØČėČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗN2O4 £Øg£©?2NO2 £Øg£©”÷H£¾0£¬·“Ó¦¹ż³ĢÖŠø÷ĪļÖŹµÄĪļÖŹµÄĮæÅضČcĖꏱ¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®
ŌŚŗćĪĀŗćČŻĢõ¼žĻĀ£¬½«Ņ»¶ØĮæNO2ŗĶN2O4µÄ»ģŗĻĘųĢåĶØČėČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗN2O4 £Øg£©?2NO2 £Øg£©”÷H£¾0£¬·“Ó¦¹ż³ĢÖŠø÷ĪļÖŹµÄĪļÖŹµÄĮæÅضČcĖꏱ¼ätµÄ±ä»Æ¹ŲĻµČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
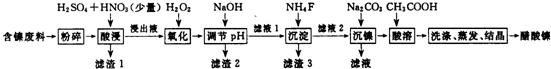
| ±ķ1 | ±ķ2 | |||
| ĪļÖŹ | æŖŹ¼³ĮµķµÄpH | ³ĮµķĶźČ«µÄpH | ĪļÖŹ | 20”ꏱČܽāŠŌ£ØH2O£© |
| Fe3+ | 1.1 | 3.2 | CaSO4 | Ī¢ČÜ |
| Fe2+ | 5.8 | ””””8.8 | NiF | æÉČÜ |
| Al3+ | 3.0 | 5.0 | CaF2 | ÄŃČÜ |
| Ni2+ | 6.7 | 9.5 | NiCO3 | KSP=9.60”Į10-6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÅäÖĘ90mL1.00mol/LµÄNaClČÜŅŗ£¬ÓĆĶŠÅĢĢģĘ½³ĘČ”5.3gNaCl¹ĢĢå | |
| B£® | Ź¹ÓĆČŻĮæĘæŹ±£¬ĻČ¼ģŃéĘäŹĒ·ńĀ©Ė®£¬Č»ŗóĻ“¾»ŗ󣬲»ÓĆøÉŌļ¼“æÉŹ¹ÓĆ | |
| C£® | æÉÓĆ10mLĮæĶ²ĮæČ”8.58mLÕōĮóĖ® | |
| D£® | ŌŚÅäÖĘČÜŅŗ¶ØČŻŗó£¬ÉĻĻĀ·×ŖŅ”ŌČŗó·¢ĻÖŅŗĆęĻĀ½µ£¬Šė¼ÓĖ®ÖĮČÜŅŗ°¼ŅŗĆęÓėæĢ¶ČĻßĻąĒŠ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com