
| ||



| 32m2 |
| 233 |
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
| A、可以推测它的化学性质与H2不同 |
| B、它比普通氢分子多一个氢原子核 |
| C、它的组成可以用H3+表示 |
| D、它一定含有3个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
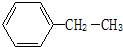
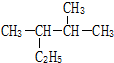
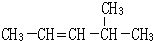
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是维生素A的分子结构:
(1)如图是维生素A的分子结构:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①测定甲同学所用Fe(N3O)3溶液的pH ② … |
若银镜消失,假设2成立.若银镜不消失,假设2不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2S在过量的O2中燃烧:2H2S+O2
| ||||
| B、向稀HNO3中加入过量的铁:Fe+4H++NO3-═Fe3++NO↑+2H2O | ||||
| C、向氯化铝溶液滴加过量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ | ||||
| D、向稀NH4HSO3溶液中滴加少量的稀NaOH溶液:NH4++OH-═NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com