
| A. | Na2CO3、NaHCO3、NaCl、NH4Cl | B. | Na2CO3、NaHCO3、NH4Cl、NaCl | ||
| C. | NH4Cl、(NH4)2SO4、Na2S、NaNO3 | D. | (NH4)2SO4、NH4Cl、NaNO3、Na2S |
分析 pH由小到大的顺序为:酸性<中性<碱性,结合盐的水解判断溶液的pH,以此来解答.
解答 解:A.Na2CO3、NaHCO3水解显碱性,且Na2CO3水解程度大,NaCl不水解,NH4Cl水解显酸性,则Na2CO3、NaHCO3、NaCl、NH4Cl的pH由大到小,故A不选;
B.Na2CO3、NaHCO3、NH4Cl、NaCl中,NH4Cl水解显酸性,其pH最小,故B不选;
C.NH4Cl、(NH4)2SO4水解显酸性,且(NH4)2SO4水解生成氢离子浓度大,NaNO3不水解,Na2S水解显碱性,则pH由小到大的顺序为(NH4)2SO4、NH4Cl、NaNO3、Na2S,故C不选;
D.NH4Cl、(NH4)2SO4水解显酸性,且(NH4)2SO4水解生成氢离子浓度大,NaNO3不水解,Na2S水解显碱性,则pH由小到大的顺序为(NH4)2SO4、NH4Cl、NaNO3、Na2S,故D选;
故选D.
点评 本题考查盐类水解及pH比较,为高频考点,把握盐类水解规律及酸碱性判断为解答的关键,侧重分析与应用能力的考查,注意氢离子浓度越大时pH越小,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
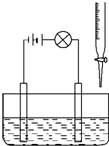 在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3mol电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:ClO-+CO2+H2O═HClO+HCO3- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁与三氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| B. | 氯化铝溶液中加入过量的氨水Al3++4NH3•H2O=4NH4++AlO2-+2H2O | |
| C. | Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 钠和冷水反应:Na+2H2O=Na++H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、CO32-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
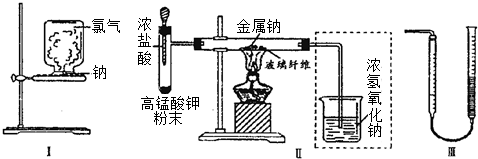
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
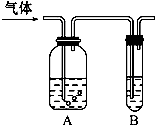 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气怵 | A中试剤 | B中试剤 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HC1 | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | CO2、HC1 | NaOH溶液 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com