
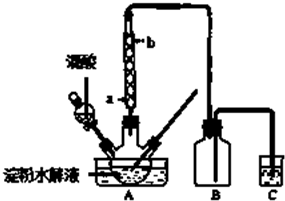
分析 Ⅰ.(1)温度低,反应速率慢,温度太高或滴加太快,会导致反应速率过快,且葡萄糖和操作能被氧化;
(2)抽滤可加快过滤速度,且能较大程度的除去水分;
(3)冷凝管中的水采用逆流方法;
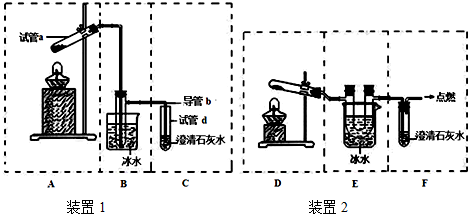
Ⅱ.(4)利用空气热胀冷缩的性质来检查装置的气密性;
(5)草酸晶体受热升华,冷凝时会形成固体;
(6)草酸也能和氢氧化钙反应生成白色沉淀;
(7)加热固体时试管口要低于试管底;产生的气体中有草酸、一氧化碳,草酸也能和氢氧化钙反应生成白色沉淀,所以要除去草酸;一氧化碳有毒,不能直接排空;用澄清石灰水检验二氧化碳.
解答 解:Ⅰ.(1)温度低,反应速率慢,温度太高或滴加太快,会导致反应速率过快,且葡萄糖和操作能被氧化,从而降低草酸的产率,
故答案为:温度太低,则反应速率慢;温度太高或滴入过快会导致草酸产率下降(C6H12O6和H2C2O4进一步被氧化);
(2)抽滤可加快过滤速度,且能较大程度的除去水分,所以能得到较干燥的沉淀,
故答案为:可加快过滤速度,并能得到较干燥的沉淀;
(3)冷凝管中的水采用逆流方法,所以a为进水口、b为出水口,故答案为:a;
Ⅱ.(4)利用空气热胀冷缩的性质来检查装置的气密性,其检验方法为如图连接好装置,将导管b没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管内有一段水柱上升,则说明该装置的气密性良好,
故答案为:如图连接好装置,将导管b没入水中,微热(或手捂)试管a,看到导管口处有气泡冒出,撤火(或松手)后,观察到导管内有一段水柱上升,则说明该装置的气密性良好;
(5)草酸易升华,得到的气体中含有草酸,如果B中的导管过长、过细,冷凝后的草酸晶体可能会堵塞导管而发生爆炸,
故答案为:B中的导管过长、过细,冷凝后的草酸晶体可能会堵塞导管而发生爆炸;
(6)草酸也能和氢氧化钙反应生成白色沉淀,草酸在冷却时生成固体,与二氧化碳分离,从而不干扰二氧化碳的检验,所以冷却的目的是防止了草酸蒸气干扰CO2的检验,
故答案为:防止了草酸蒸气干扰CO2的检验;
(7)加热固体时试管口要低于试管底,由于草酸在101℃时熔化,反应装置中试管口应向上倾斜,故选A装置;
产生的气体中有草酸、一氧化碳,选择装置E除去草酸,一氧化碳有毒,具有可燃性,可采用点燃的方法除去尾气中的一氧化碳,二氧化碳能使澄清石灰水变浑浊,因此一般用澄清石灰水检验二氧化碳的存在,故选装置F;所有组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为:A、E、F,
故答案为:AEF.
点评 本题考查物质制备,为高频考点,涉及仪器的使用、实验设计中仪器的选取、实验条件的确定等知识点,明确实验原理、物质的性质、仪器的用途等知识点是解本题关键,侧重考查学生实验设计、实验分析及知识的综合应用能力,高中学生对于抽滤装置了解较少,应该多加练习掌握,题目难度中等.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题

| A. | 2:7 | B. | 5:4 | C. | 1:1 | D. | 7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M/NA表示该气体单个分子的质量 | B. | mNA/M表示该气体的分子数 | ||
| C. | M/22.4表示该气体的密度 | D. | VM/mNA表示该气体一个分子的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
 C6H5COOCH3+H218O.
C6H5COOCH3+H218O.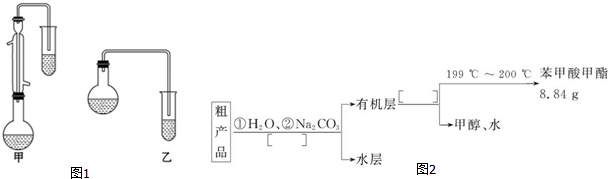
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
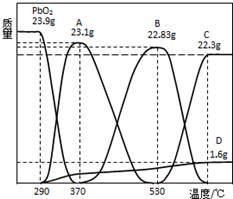 某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com