
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②常温下pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13 mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Al3+、Cl﹣、S2﹣
⑥使pH试纸呈红色的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣.
|
| A. | ②④ | B. | ③⑤ | C. | ④⑥ | D. | ②⑤ |
考点:
离子共存问题.
专题:
离子反应专题.
分析:
①Cu2+为蓝色;
②pH=11的溶液,显碱性,该组离子之间不反应;
③加入Al能放出H2的溶液,为酸或强碱溶液;
④由水电离出的c(OH﹣)=10﹣13 mol•L﹣1的溶液,为酸或碱溶液;
⑤能使红色石蕊试纸变为蓝色的溶液,显碱性;
⑥使pH试纸呈红色的溶液,显酸性.
解答:
解:①Cu2+为蓝色,与无色溶液不符,故错误;
②pH=11的溶液,显碱性,该组离子之间不反应,则能共存,故正确;
③加入Al能放出H2的溶液,为酸或强碱溶液,HCO3﹣既能与酸反应又能与碱反应,则不能共存,故错误;
④由水电离出的c(OH﹣)=10﹣13 mol•L﹣1的溶液,为酸或碱溶液,该组离子在酸或碱溶液中不反应,能共存,故正确;
⑤能使红色石蕊试纸变为蓝色的溶液,显碱性,Al3+与碱反应,且Al3+、S2﹣相互促进水解,则不能共存,故错误;
⑥使pH试纸呈红色的溶液,显酸性,Fe2+、H+、NO3﹣发生氧化还原反应,则不能共存,故错误;
故选A.
点评:
本题考查离子的共存,明确习题中的信息及离子之间的反应即可解答,注意离子的颜色及发生的氧化还原反应为解答的易错点,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
(1)25℃时,0.01mol•L﹣1NaOH溶液的pH=
(2)25℃时,将1L pH=a的HCl与100L pH=11的NaOH溶液混合后,溶液呈中性,则a= .
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,某溶液中由水电离出的c(OH﹣)=10﹣5 mol•L﹣1,则其溶质可能是( )
|
| A. | CH3COOH | B. | H2SO4 | C. | NaOH | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程或现象与盐类水解无关的是( )
|
| A. | 热的Na2CO3溶液可以除去油污 |
|
| B. | ZnCl2和NH4Cl溶液可作金属焊接中的除锈剂 |
|
| C. | 用食醋除水垢 |
|
| D. | 将AlCl3溶液加热蒸干、灼烧,最后得到的固体时Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,反应SO2(g)+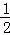 O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
O2(g)⇌SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)⇌2SO2(g)+O2(g)的平衡常数K2的值为( )
|
| A. | 2500 | B. | 100 | C. | 4×10﹣4 | D. | 2×10﹣2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是 溶液,D是 溶液.
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是 .
A.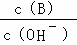 B.
B.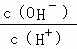 C.c (H+)•c (OH﹣) D.n (OH﹣)
C.c (H+)•c (OH﹣) D.n (OH﹣)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则 (填化学式)溶液中锌粉有剩余.
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 .
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10﹣7mol/L,则 Ksp[Mg(OH)2]= .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,甲池的总反应式O2+N2H4 2H2O+N2。有关该装置工作时,说法正确的是
2H2O+N2。有关该装置工作时,说法正确的是
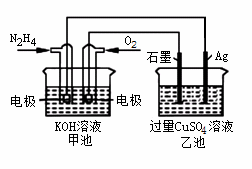
A.甲池中,负极反应为N2H4-4e- 4H++N2
4H++N2
B.甲池溶液pH保持不变,乙池溶液pH减小
C.甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体
D.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图所示,回答下列问题:
(1)若a=5,则A为 酸,B为 酸(填“强”、或“弱”),若再稀释100倍,则A的pH 7(填“<”、“>”或“=”).
(2)若A、B都是弱酸,则a的范围是 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com