
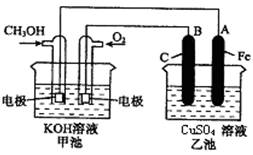
科目:高中化学 来源:不详 题型:单选题
| A.2Fe+ O2 + 2H2O=2Fe(OH)2 | B.4Fe(OH)2+O2 +2H2O=4Fe(OH)3 |
| C.O2 + 2H2O + 4e-→ 4OH- | D.Fe → Fe3++3e- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
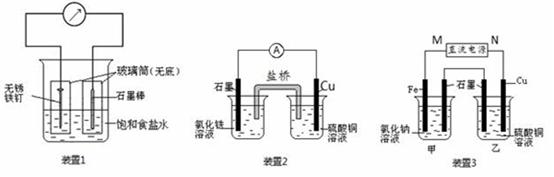
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电镀时,应把镀件置于电解槽的阴极,电镀液应含有镀层金属的阳离子 |
| B.中国第1艘液化天然气船“大鹏昊”船底镶嵌锌块,锌作负极,可以防止船体被腐蚀 |
| C.电解水的过程中,阴极区附近的溶液的pH会降低 |
| D.将钢铁与电源的负极相连可以起到保护钢铁的作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.轮船水线以下的船壳上装一定数量的锌块 |
| B.铁可以在氯气中燃烧 |
| C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D.镀锌的铁比镀锡的铁耐用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
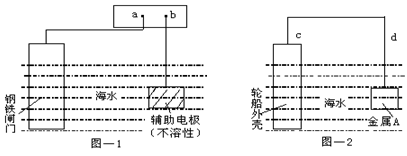
| A.图—1:a为电源正极 | B.图—1:辅助电极上的反应:O2+4e+2H2O→4OH- |
| C.图—2:电子流动方向d→c | D.图—2:金属A可以是耐腐蚀的金属铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁发生电化腐蚀的正极反应式:Fe-2e-="=" Fe2+ |
| B.为实现铁上镀铜,可让铁做阳极. |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-==Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
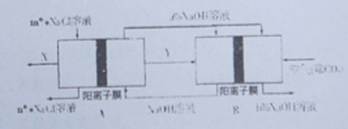
| A.X为H2,Y这Cl2 |
| B.A池为电解池,且m<n |
| C.B池为燃料电池,且a<b |
| D.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com