
����Ŀ��ij��ѧ�о���ѧϰС�����ʵ��̽��ͭ�ij�����ѧ���ʣ�����������£��������
����1�������ڱ��У�ͭ������λ�úܽӽ���ͭ���������ã����������������ԣ�������ͭҲ��������
����2������ͭ���б�ۣ�һ������£������������ȶ���С�������۵�������һ��ͭ���ȶ���ҲС�������۵�ͭ��
����3������ͭ�������ԣ��ܱ�H2��CO��ԭ����Ҳ�ܱ�����ij����̬�⻯�ﻹԭ��
ʵ��̽��
��1��I���������1
a.���õ���ҩƷ��1molL��1CuSO4��Һ��ϡ�������________�����Լ��Ļ�ѧʽ����Һ��
b.�õ�����������1molL��1CuSO4��Һ250mL��ѡ�õ��������ձ���������ƽ��ҩ�ס�
����������ͷ�ι��⣬����________�����������ƣ���
c.Ϊ�ﵽʵ��Ŀ�ģ����㲹ȫʵ�����ݺͲ��裺
����CuSO4��Һ�Ʊ�Cu��OH��2��
��________��
��2�������������2
ȡһ����I���Ʊ���õ�������ͭ���������������գ����¶ȴﵽ80��100���õ���ɫ�����ĩ������������1000�����ϣ���ɫ��ĩȫ����ɺ�ɫ��ĩ������ͭ��ȡ������ɫ������ͭ��ĩ�ڽྻ�Թ��У����������ϡ���ᣨ�����ᣩ���õ���ɫ��Һ��ͬʱ�۲쵽�Թܵײ����к�ɫ������ڣ���������ʵ������ش����⣮
a.д��������ͭ��ϡ���ᣨ�����ᣩ��Ӧ�����ӷ���ʽ��________��
b.��ʵ�����ɵó��Ľ������ڸ�������һ��ͭ��������ͭ________�����ȶ����ȶ�������Һ����һ��ͭ��������ͭ________�����ȶ����ȶ�����
��3�������������3�������װ�ã��г�װ��δ��������

������ij����̬�⻯�X������ͨ�����ȵ�����ͭʱ���۲쵽����ͭ�ɺ�ɫ����˺�ɫ����ˮ����ͭ�����ɫ���������л���һ������Ⱦ�ĵ�������Y����Xͨ�����ȵ�CuOȼ�չ���ȫ��Ӧ������0.01mol X�����Bװ������0.36g�����ռ���0.28g����Y��
a.����A��������________��
b.X�Ļ�ѧʽΪ________��
���𰸡� NaOH��Һ 250mL������ƿ ��Cu��OH��2�ֱ����ϡ�����ϡNaOH��Һ�����۲����� Cu2O+2H+=Cu+Cu2++H2O �ȶ� ���ȶ� ����� N2H4
���������������������1����̽��������ͭ�Ƿ�������Ե�ʵ����Ҫ��ҩƷ�ǣ���ȡ������ͭ������ͭ���������ƣ���֤�����õ�������������ƣ�������Ҫ����ͭ�����������Լ�������Һ�������õ���ҩƷ��1 mol��L-1CuSO4��Һ��ϡ�����������������Һ����2������һ�����ʵ���Ũ�ȵ���Һ�����������ձ�����ƽ������������Ͳ����ͷ�ιܡ�һ�����������ƿ������ƿ�Ĺ����������õ���Һ��ȷ�����ʴ�Ϊ��250mL����ƿ����3��������ͭ�Ƿ��ܺ�������������Ʒ�Ӧ��ʵ���У�������������ͭ�����ƣ�Ȼ������������ͭ�������Լ��������Ʒ�Ӧ������ʵ�鲽���һ���ǣ���CuSO4��Һ��NaOH��Һ��Cu��OH��2���ڶ����ǣ���Cu��OH��2�ֱ���ϡH2SO4��NaOH��Һ��Ӧ���ʴ�Ϊ����Cu��OH��2�ֱ���ϡH2SO4��NaOH��Һ��Ӧ��
������1����������֪��������ͭ��ϡ���ᣨ�����ᣩ��Ӧ���ɽ�������ͭ�Ͷ���ͭ���ӵ�����Һ�����ӷ���ʽΪCu2O+2H+=Cu+Cu2++H2O����2�����������Ϣ֪����������һ��ͭ��������ͭ�ȶ�����Һ����һ��ͭ��������ͭ���ȶ���
������1������A������Ϊ����ܣ���2��������֪������0.01mol X�����Bװ������0.36g��������0.02mol��ˮ�����ռ�����������Y 0.28g������0.01mol������ԭ���غ����ȷ����̬�⻯��X�к���4����ԭ�Ӻ�2����ԭ�ӣ�X�Ļ�ѧʽΪN2H4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
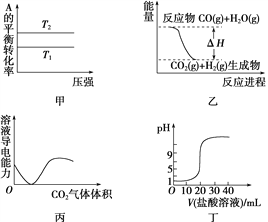
A. ��ͼ�����жϣ����ڷ�ӦA(g)��B(g) ![]() 2C(g)����T1>T2������H<0
2C(g)����T1>T2������H<0
B. ͼ�ұ�ʾ���淴ӦCO(g)��H2O(g) ![]() CO2(g)��H2(g)����H>0
CO2(g)��H2(g)����H>0
C. ͼ����ʾCO2ͨ�뱥��Na2CO3��Һ�У���Һ�����Ա仯
D. ͼ����ʾ0.1 mol��L��1������ζ�20 mL 0.1 mol��L��1 NaOH��Һ����ҺpH�������������ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�齫V1mL0.50mol/LH2SO4��Һ��V2mLδ֪Ũ�ȵ�NaOH��Һ��Ͼ��Ⱥ��������¼��Һ�¶ȣ�ʵ��װ�ú�ʵ��������ͼ��ʾ(ʵ����ʼ�ձ���V1 +V2=50mL)���ش��������⣺
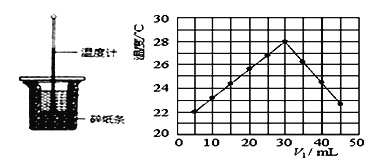
��1����ͼ��ʾʵ��װ������һ�����ԵĴ���________________��
��2��Ϊ�˼���ʵ����ʵ������н�NaOH��Һ________________ (ѡ����һ���������ֶ����������ʢ��ϡ�����С�ձ��С���Һ��Ϻ�ȷ��ȡ�����Һ��____________����Ϊ��ֹ�¶ȡ�
��3���о�С������ʵ��ʱ�����¶�________ 22��C(����������� ��������������������
��4������ɼ�ͼ�ο�֪�˷�Ӧ����NaOH��Һ��Ũ��ӦΪ_________ mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�뻷�����������彡�����������ϵ�ϢϢ��ء�
��1����Ȼˮ�����ʽ϶࣮�������������ClO2�����ʴ�����������á�����ClO2 ��������__������������Al3+ˮ������ӷ���ʽ��_________________________��
��2����װ��������ࡣ���������в�������Ȼ��ά����__________������ţ���
a������ b��˿��ë c�����ںͽ���
��3��������ʴ����ɾ�ľ�����ʧ�������ڳ�ʪ�Ŀ����и�����ʴ����Ҫԭ���Ǹ����������̼��������С��___________�������绯ѧ��ʴ��
��4���������������������ҹ��������̽�����Ⱥӣ����Ʊ�������ʹ����þ���Ͻ�þ���Ͻ���ŵ���_________��a��ǿ�ȴ� b���ܶȴ� c����Ե�Ժ� d����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֽ���������ɵĻ����11g���ӵ�����ϡ�����У����յõ�11.2L����״���£��������������ֽ��������ǣ� ��
A.Zn��Fe
B.Ag��Mg
C.Al�� Cu
D.Mg��Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Na2CO3��NaHCO3���ʵ�˵����ȷ���ǣ� ��
A.��Ũ��ʱˮ��Һ���ԣ�NaHCO3��Na2CO3
B.���ȶ��ԣ�NaHCO3��Na2CO3
C.��������Һ��Ӧ�����ʣ���������NaHCO3��Na2CO3
D.��������Na2CO3��NaHCO3�ֱ������������ᷴӦ��NaHCO3������CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������SO3����ͨ��KOH��Ba(OH)2��KAIO2�������ʵĻ����Һ�У���ͼ��ʾ���ɳ��������SO3�����ʵ����Ĺ�ϵ�����ͼ����
A. 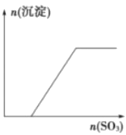 B.
B. 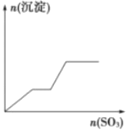
C. 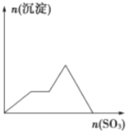 D.
D. 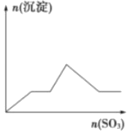
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����������DO���Ǻ���ˮ���Ծ�������һ��ָ�꣬ͨ����ÿ��ˮ���ܽ������ӵ�������ʾ����λmg��L-1���ҹ����ر�ˮ�������������涨����������ˮԴ��DO���ܵ���5 mg��L-1��ˮ���ܽ����IJⶨ�������£�
��1����һ����ˮ���м�������MnSO4�ͼ���KI��Һ������MnO��OH��2�������ܷ⾲�ã�
��2����������ϡH2SO4�����裬��MnO��OH��2��I-��ȫ��Ӧ����Mn2+��I2��
��3����Na2S2O3����Һ�ζ����յ㡣
�ⶨ���������ʵ�ת����ϵ���£�

��֪��MnO��OH��2+2I-+4H+ =Mn2++I2+3H2O 2S2O32- +I2= S4O62-+2I-
�ټ���ϡ���������������__________��Na2S2O3����ҺӦװ��______________�ζ�����������ʽ���ʽ����
�ڵζ���������_____________Ϊָʾ�����ﵽ�ζ��յ�ı�־Ϊ____________________��
��д��O2��Mn2+������MnO��OH��2�����ӷ���ʽ____________________��
���������ϡH2SO4��Һ��Ӧ������ҺpH���ͣ��ζ�ʱ��������Ե���д����������һ��ԭ���������ӷ���ʽ��ʾ��__________________��
�����в���ʹ���ˮ������������DO����ʵ��ֵƫ�ߵ���__________________��
A.����1������������ʱû���ܷ� B.װNa2S2O3����Һ�ĵζ���û����ϴ
C.�ζ�ǰ��ƿϴ����û�и��� D.�ζ�ǰ������ȷ���ζ����Ӷ���
��ȡ�ӹ�һ����CaO2��8H2O�ij���ˮ��l00.00mL�������������ⶨˮ���ܽ�����������0.01000
mol��L-1 Na2S2O3����Һ13.50 mL�������ˮ���е��ܽ���Ϊ____________mg��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��ѧ���Ķ��ѹ����зų����� B. ԭ��صĸ�������������Ӧ
C. ԭ��ص���������������Ӧ D. ��ѧ���γɵĹ�����Ҫ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com