
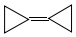
 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 是环丙烷的同系物 | ||
| C. | 与环己二烯( 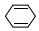 )是同分异构体 )是同分异构体 | D. | 所有的碳原子均在同一平面内 |
分析 含有碳碳双键,具有乙烯的性质,且所有碳原子都连接在碳碳双键,碳原子具有平面形结构,结合结构特点解答该题.
解答 解:A.结构对称,且为平面形结构,只有一种H,则一氯取代物有1种,故A正确;
B.环烷烃只含有1个环,原子之间都是单键,该物质含有2个环、1个C=C双键,与环丙烷不是同系物,故B错误;
C.环己二烯的分子式为C6H8,环丙烷叉环丙烷的分子式为C6H8,二者结构不同,分子式相同,互为同分异构体,故C正确;
D.所有碳原子都连接在碳碳双键,具有平面形结构,所有的碳原子均在同一平面内,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重同分异构体的书写与判断、同系物以及分子的空间结构等,难度中等,D中注意所有的C原子处于同一平面.


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏可用于分离提纯液态有机混合物 | |
| B. | 乙烯和甲烷可用酸性KMnO4溶液鉴别 | |
| C. | 甲烷和氯气发生取代反应需要光照 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{②}^{NaOH、乙醇}$
$→_{②}^{NaOH、乙醇}$ $→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH5中含有5NA个N-H键 | |
| B. | NH5中既含有共价键,又含有离子键,是离子化合物 | |
| C. | NH5的熔、沸点高于NH3 | |
| D. | NH5固体投入少量水中可产生两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将煤粉碎后燃烧 | B. | 通入大量的空气 | ||
| C. | 加入的煤越多越好 | D. | 将煤和空气在密闭的空间里燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子结构或性质 |
| A | 其形成的一种同位素元素在考古中可推测化石的年代 |
| B | 与A同周期,其最高价氧化物的水化物无论浓、稀溶液均有强氧化性 |
| C | 地壳中含量最多的元素 |
| D | D原子的最外层电子数与其电子层数相同,是地壳中含量最多的金属元素 |
| E | 其单质主要存在于火山口附近 |
| F | 生活中常见的金属,它的某种氧化物均有磁性 |
| G | G原子与D原子同周期,且原子半径是同周期元素中最大的 |
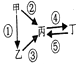
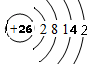 ;
; ,
,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com