
| A. | 0.4 mol/L | B. | 0.6 mol/L | C. | 0.8 mol/L | D. | 1.0 mol/L |
分析 进入溶液的是铁元素,产生的是NO气体,根据差量法可以计算一氧化氮的质量,金属和硝酸之间的反应分为铁过量和不足两种情况,可以根据一氧化氮的物质的量确定是哪种情况,根据电子守恒和元素守恒设未知数进行计算即可.
解答 解:铁与稀硝酸可能发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
由质量守恒可知m(NO)=14g-8g=6g,n(NO)=$\frac{6g}{30g/mol}$=0.2mol,
14g铁的物质的量为:n(Fe)=$\frac{14g}{56g/mol}$=0.25mol,
若生成Fe(NO3)3,则生成0.25molNO,
如生成Fe(NO3)2,则生成0.25mol×$\frac{2}{3}$=$\frac{0.5}{3}$molNO,
则说明反应后生成Fe(NO3)3和Fe(NO3)2的混合物,
设Fe(NO3)3和Fe(NO3)2物质的量分别为xmol、ymol,
根据Fe元素守恒及电子转移守恒可得:x+y=0.25,3x+2y=0.2×3,
解得x=0.1、y=0.15,
根据N元素守恒可知,n(HNO3)=3n[Fe(NO3)3]+2n[Fe(NO3)2]+n(NO)=3×0.1mol+2×0.15mol+0.2mol=0.8mol,
原硝酸的物质的量浓度为:$\frac{0.8mol}{1L}$=0.8 mol/L,
故选C.
点评 本题考查化学方程式的计算,题目难度中等,正确判断反应产物为解答关键,注意元素守恒和电子守恒的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物一定不是共价化合 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 3 | ② | ③ | ⑧ | ⑩ | ||||
| 4 | ① | ⑨ |
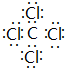 ,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为
,该分子含有极性(填“极性”或“非极性”)键;⑤元素形成的单质的结构式为N≡N⑧元素形成简单离子的结构示意图为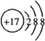 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应一定只伴随热量的变化 | |
| B. | 凡是吸热或放热过程中热量的变化均称为反应热 | |
| C. | 若△H<0,则反应物的能量高于生成物的能量 | |
| D. | 若△H>0,则反应物的能量高于生成物的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
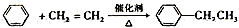

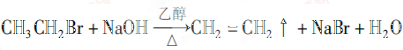 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH2CH3和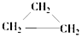 | B. |  和 和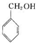 | ||
| C. | 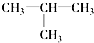 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com