
����Ŀ��A��J���dz��л�ѧ���õ����ʡ�����B��E��H��J�ǵ��ʣ������Ϊ���������C�����������������ת����ϵ����ͼ��ʾ�����ַ�Ӧ������P��Ӧ��������ȥ����

��ش��������⣺
��д������D��J�Ļ�ѧʽ��D___________,J___________��
��������C��B����ת�����̣�����Ȼ���г�Ϊ____________���á�
�Ƿ�Ӧ�ٵķ�Ӧ����___________���������Ӧ����___________��
��д����Ӧ�ڵĻ�ѧ����ʽ��______________________��
����Ҫʵ����H+I����ɫ����J����ת��������I���������������___________��
���𰸡�CaCO3 Cu ��� ��ȼ ���Ϸ�Ӧ C + CO2 ![]() 2CO ������ͭ��
2CO ������ͭ��
��������
����A-J���dz��л�ѧ���������ʣ�B��E��H��J�ǵ��ʣ������Ϊ���������C�������������C�Ƕ�����̼��������̼���������ƻ�����̼��Ƴ�����ˮ������D��̼��ƣ�������̼��̼���»�����һ����̼������E��ľ̿��F��һ����̼��һ����̼��G���ɵĻ�ת���ɺ�ɫ����J������G����������H������I����������ͭ��J��ͭ������B�����ɺ�ɫ����A������B��������A��������������Ȼ���Ƴ������ʽ�����֤���ɡ�
��������������֪��
��1��D��CaCO3��J��Cu���ʴ�Ϊ��CaCO3��Cu��
��2��������C��B����ת�������Ƕ�����̼ת��������������Ȼ���г�Ϊ������ã��ʴ�Ϊ����ϣ�
��3����Ӧ�������������ڵ�ȼ��������������������������Ӧ�����ǵ�ȼ���÷�Ӧ���㻯�Ϸ�Ӧ���һ�����������ڻ��Ϸ�Ӧ���ʴ�Ϊ����ȼ�����Ϸ�Ӧ��
��4����Ӧ���Ƕ�����̼��ľ̿�ڸ��µ�����������һ����̼����ѧ����ʽΪ��C+CO2![]() 2CO��
2CO��
��5����Ҫʵ����H+I����ɫ����J����ת��������I��������������ǿ�����ͭ�Σ��ʴ�Ϊ��������ͭ�Ρ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ�����ȷ����(����)
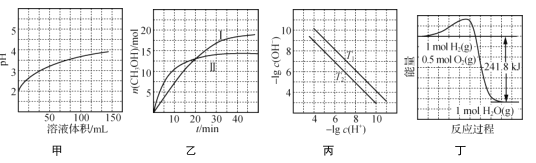
A. ͼ�ױ�ʾ1 mL pH��2ijһԪ����Һ��ˮϡ��ʱ��pH����Һ������ı仯���ߣ�˵��������ǿ��
B. ͼ�ұ�ʾ�����ܱ�����������������ͬʱ�ı��¶ȣ���ӦCO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g)��n(CH3OH)��ʱ��ı仯���ߣ�˵����Ӧƽ�ⳣ��K��>K��
CH3OH(g)��H2O(g)��n(CH3OH)��ʱ��ı仯���ߣ�˵����Ӧƽ�ⳣ��K��>K��
C. ͼ����ʾ��ͬ�¶���ˮ��Һ�У�lg c(H��)����lg c(OH��)�仯���ߣ�˵��T1>T2
D. ͼ����ʾ1 mol H2��0.5 mol O2��Ӧ����1 mol H2O�����е������仯���ߣ�˵��H2��ȼ������241.8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000 mol��L��1 NaOH��Һ�ζ�20.00 mL 0.1000 mol��L��1 CH3COOH��Һ���õζ���������ͼ������˵����ȷ����

A. �����ʾ��Һ�У�c(CH3COO��)��c(OH��)��c(Na+)��c(H��)
B. �����ʾ��Һ�У�c(Na��)��c(CH3COOH)��c(CH3COO��)
C. �����ʾ��Һ�У�NaOH��CH3COOHǡ����ȫ�кͣ���Һ������
D. ��0.1000 mol��L��1 CH3COOH��Һ�У���ˮ���������c(H��)= 10��13 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ������ȷ��ӳ����Ӧ������ϵ����( )

A. ��pH=3����Һ�в��ϼ�ˮ
B. һ������ϡ������п����Ӧ
C. ��H2SO4��CuSO4���Һ�еμ�NaOH��Һ
D. ����һ��������ʯ��ʯ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. ��֪��
��ӦFe��s��+CO2��g��![]() FeO��s��+CO��g����ƽ�ⳣ��ΪK1��
FeO��s��+CO��g����ƽ�ⳣ��ΪK1��
��ӦFe��s��+H2O��g��![]() FeO��s��+H2��g����ƽ�ⳣ��ΪK2��
FeO��s��+H2��g����ƽ�ⳣ��ΪK2��
�ڲ�ͬ�¶�ʱK1��K2��ֵ���±���
�¶ȣ������¶ȣ� | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
��1���Ƶ���ӦCO2��g��+H2��g��![]() CO��g��+H2O��g����ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ��___________���жϸ÷�Ӧ��___________��Ӧ������ȡ����ȡ�����
CO��g��+H2O��g����ƽ�ⳣ��K��K1��K2�Ĺ�ϵʽ��___________���жϸ÷�Ӧ��___________��Ӧ������ȡ����ȡ�����
II. T1�¶��£����Ϊ 2L�ĺ����ܱ�����������4.00molX��2.00molY��������ѧ��Ӧ 2X(g)+Y(g)![]() 3M(g)+N(s) ��H<0������ʵ�������������ʾ��
3M(g)+N(s) ��H<0������ʵ�������������ʾ��
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
��2��ǰ500s��Ӧ����v(M)��____________���÷�Ӧ��ƽ�ⳣ��K��_____________��
��3���÷�Ӧ�ﵽƽ��ʱij���������¶ȱ仯����ͼ��ʾ����������Ա�ʾ������������Щ_____��

a��Y���淴Ӧ���� b��M���������
c����������ƽ����Է������� d��X����������
��4����Ӧ�ﵽƽ������ټ���3.00molM��3.00molN������˵����ȷ����_____��
A��ƽ�ⲻ�ƶ�
B�����´�ƽ���M���������С��50%
C�����´�ƽ���M�����ʵ���Ũ����ԭƽ���1��5��
D�����´�ƽ���Y��ƽ����Ӧ������ԭƽ�����
E�����´�ƽ�����X��ʾ��v(��)��ԭƽ���
��5��������Ϊ���Ⱥ�����������ʼʱ����4.00molX��2.00molY�����ƽ���M�����ʵ���Ũ��_____1.5mol/L(�>������=����<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ЧӦ����ȫ���ע�Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������壬CO2���ۺ������ǽ�����Ҽ���Դ�������Ч;����
��1��CO2�������ܺϳɵ�̼ϩ����2CO2(g)��6H2(g)![]() C2H4(g)��4H2O(g)����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ��ʾ��������b��ʾ������Ϊ________(�ѧʽ)��
C2H4(g)��4H2O(g)����ͬ�¶���ƽ��ʱ��������̬���ʵ����ʵ�����ͼ��ʾ��������b��ʾ������Ϊ________(�ѧʽ)��

��2��CO2��H2�ڴ���Cu/ZnO�����¿ɷ�������ƽ�з�Ӧ���ֱ�����CH3OH��CO��
��ӦA��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)
CH3OH(g)��H2O(g)
��ӦB��CO2(g)��H2(g)![]() CO(g)��H2O(g)
CO(g)��H2O(g)
����CO2��H2��ʼͶ�ϱ�Ϊ1��3ʱ���¶ȶ�CO2ƽ��ת���ʼ��״���CO���ʵ�Ӱ����ͼ��ʾ��

����ͼ��֪�¶�����CO�IJ�������������Ҫԭ�������_____��
����ͼ��֪��ȡCH3OH�����˵��¶���________�����д�ʩ���������CO2ת��ΪCH3OH��ƽ��ת���ʵ���________(����ĸ)��
A. ʹ�ô���
B. ������ϵѹǿ
C. ����CO2��H2�ij�ʼͶ�ϱ�
D. Ͷ�ϱȺ�����������䣬���ӷ�Ӧ���Ũ��
��3���ں��º��������£���ӦA�ﵽƽ��ı�־��_____
A. ����������ѹǿ���ٷ����仯
B. �����������ܶȲ��ٷ����仯
C. ������������ɫ���ٷ����仯
D. ����������ƽ��Ħ���������ٷ����仯
��4����CO2��ȡC��̫���ܹ�����ͼ��ʾ�����ȷֽ�ϵͳ�������ķ�ӦΪ2Fe3O4![]() 6FeO��O2����ÿ�ֽ�1 mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ_____��������ϵͳ��������Ӧ�Ļ�ѧ����ʽΪ___��
6FeO��O2����ÿ�ֽ�1 mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ_____��������ϵͳ��������Ӧ�Ļ�ѧ����ʽΪ___��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̫���ܵ�صķ�չ�������ͻ�����Ĥ�������²�Ʒ��ͭ��(Ga)��(Se)�Ȼ����ﱡĤ̫���ܵ�غ�Siϵ��Ĥ̫���ܵ�ء����������գ�
��1��Cu����̬ʱ�ĵ����Ų�ʽ_________��1mol�������[Cu(NH3)2]+ �У����ЦҼ���ĿΪ__________��
��2����֪��Ԫ������Ԫ�ش���ͬһ���壬BF3���ӵĿռ乹��Ϊ_____��
��3������ͬ�������ڵ�Ԫ��Ϊ����壬��������Ԫ�صĵ�һ�����ܴӴ�С˳��Ϊ_______����Ԫ�ط��ű�ʾ����H2Se�ķе��H2O�ķе�ͣ���ԭ����___________��
��4��������Ľṹ����ʯ�ṹ���ƣ��������ʯ������һ���Cԭ�ӻ���Siԭ����ͬ��ԭ�Ӳ��ɼ��������ͼ��ʾ�Ľ��ɰ�ṹ���ھ����У�ÿ��Siԭ����Χ�����Cԭ����ĿΪ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С��ͬѧ����CuSO4��5H2O����500mL0.1mol��L-1CuSO4��Һ��
(1)С��ͬѧѡ�õ�����ƿ���Ϊ_______mL��
(2)�������ڸ�ʵ��������Ҫ����;���ֱ���________ ��__________��
(3)С��ͬѧͨ�����㣬��������ƽ��ȡ_________ gCuSO4��5H2O��
(4)�й����ʵ���Ũ�ȵ�������������ƫ��������ƫ����������Ӱ����������������ƿϴ��δΪ�����������ˮ�֣�����������Һ��Ũ�Ƚ�__________���ڶ���ʱ�������ӿ̶��ߣ��������Ƶ���ҺŨ�Ƚ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�����2molA��1molB�������·�Ӧ��2A(g)+B(?)![]() 2C(g)+D(g)��C�����������C%) ��ʱ��ı仯���Ʒ�������ͼ��ϵ������˵����ȷ������������
2C(g)+D(g)��C�����������C%) ��ʱ��ı仯���Ʒ�������ͼ��ϵ������˵����ȷ������������
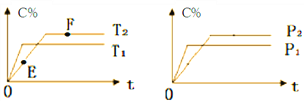
A. E���v(��)����F���v(��)
B. ����F��ʱ��������ѹ������ƽ��ʱC��Ũ�Ƚ�����
C. �����������ȣ��÷�Ӧ��ƽ�ⳣ��K������
D. ���º����´�ƽ������������ټ���2molA��1molB��A��ת���ʲ������ı�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com