
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______。
(2)画出虚线框内的实验装置图____________,并注明所加试剂,说明装置的作用_____________。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),实验现象为________,化学反应方程式是________________。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因。_________。
【答案】浓盐酸 MnO2 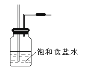 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 Na2S+Cl2=2NaCl+S↓ Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强。
除去Cl2中的HCl气体 A 有淡黄色沉淀生成 Na2S+Cl2=2NaCl+S↓ Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强。
【解析】
(1)A装置用于制取氯气,加热条件下浓盐酸和二氧化锰反应生成氯化锰、氯气和水;
(2)浓盐酸具有挥发性,所以生成的氯气中含有HCl,饱和食盐水能溶解HCl但是能抑制氯气溶解,所以用饱和食盐水除去氯气中的HCl;
(3)要证明氯元素的非金属性比S元素强,可以用氯气氧化硫离子生成S来实现;
(4)从原子结构的特点:氯原子的半径小于S原子半径,半径小,得电子能力强,据此回答。
(1)A装置用于制取氯气,实验室是用浓盐酸和二氧化锰在加热条件下反应生成二氯化锰、氯气和水,反应方程式为![]() ,所以分液漏斗中盛放的是浓盐酸、烧瓶中加入的是MnO2;
,所以分液漏斗中盛放的是浓盐酸、烧瓶中加入的是MnO2;
故答案为:浓盐酸;MnO2;
(2)浓盐酸具有挥发性,所以生成的氯气中含有HCl,饱和食盐水能溶解HCl但是能抑制氯气溶解,所以用饱和食盐水除去氯气中的HCl,所以广口瓶中盛放的是饱和食盐水,如图所示 ,其作用是除去氯气中的HCl;
,其作用是除去氯气中的HCl;
故答案为: ;除去氯气中的HCl;
;除去氯气中的HCl;
(3)根据非金属性与其单质的氧化性一致,又根据同一氧化还原反应中氧化剂的氧化性大于氧化产物,故要证明氯元素的非金属性比S元素强,可以用氯气氧化硫离子生成S来实现,生成淡黄色沉淀S,反应方程式为:Na2S+Cl2=2NaCl+S↓;
故答案为:A;有淡黄色沉淀生成;Na2S+Cl2=2NaCl+S↓;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl原子得电子能力比S强,非金属性Cl比S强;
答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强。


科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们日常生活中的吃、穿、住、行、医关系密切:
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质,在人体内都能发生水解。
①油脂在酸性条件下水解的最终产物是_________和_________;
②上述三种物质不属高分子化合物的是_________,若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量水解实验的溶液加入_________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量水解溶液加入几滴________,应观察到出现蓝色;
③蛋白质在人体内水解的最终产物是氨基酸.写出氨基酸共同含有的官能团的结构简式分别为_________和﹣COOH;
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久.它能长期使用的原因是_________,橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施使其分子转变为_________分子结构可增大强度和弹性;
(3)聚丙烯腈﹣合成腈纶又称人造羊毛,丙烯腈为CH2=CHCN,请写出聚丙烯腈的结构简式_________,生活中除常用的氯系消毒剂外,过氧乙酸是另一种常见消毒剂,主要是因为其结构中含有_________而表现出强氧化性;
(4)_________形成的合金被称为“亲生物金属”,广泛作为人造骨的材料.为防止工业生产过程产生的悬浮颗粒物进入大气,可以将混有悬浮颗粒物的气体通过沉降进行处理;
(5)居室装修所用的有些石材会释放出一种放射性物质,长期接触可能引起癌症,免疫功能异常,该放射性物质主要是_________(填写该物质的名称);
(6)氢氧化铝、碳酸镁都可用于治疗胃酸过多引起的不适,请分别写出相关反应的离子方程式:①_________②_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为:![]() 饱和
饱和![]() .
.
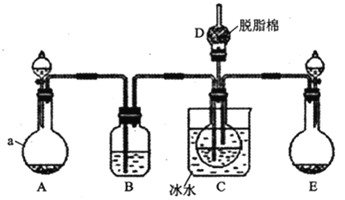
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去.
可选用的药品有:①石灰石②生石灰③![]() 盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
请回答下列问题
(1)仪器a的名称是______.
(2)![]() 中应选用的药品是______
中应选用的药品是______![]() 填序号
填序号![]()
(3)在实验过程中,应先向C中通入的气体的化学式是______,其原因是______.
(4)![]() 中脱脂棉应浸润的试剂是______
中脱脂棉应浸润的试剂是______![]() 填写字母编号
填写字母编号![]()
![]() 浓硫酸
浓硫酸 ![]() 稀硫酸
稀硫酸 ![]() 氢氧化钠溶液
氢氧化钠溶液 ![]() 浓硝酸
浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:
,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:

![]() 操作Ⅲ中的方法是______,______,______
操作Ⅲ中的方法是______,______,______
![]() 所得晶体中碳酸氢钠的纯度是______
所得晶体中碳酸氢钠的纯度是______![]() 不必化简
不必化简![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是

A.电子由Al电极通过外电路流向Ag2O/Ag电极
B.电池负极附近溶液pH下降
C.溶液中OH-向Al电极移动
D.Al极反应式为:Al-3e-+3OH-=Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用作棉纺、造纸业的漂白剂,也可用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠(NaClO3)等为原料制备亚氯酸钠的工艺流程如下:

(1)ClO2中Cl的化合价为________。
(2)从“母液”中回收的主要物质是________(填化学式)。
(3)“冷却结晶”后需________(填操作名称),该操作用到的玻璃仪器有________。
(4)反应2中转移0.1NA个电子时,生成NaClO2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______(用对应的元素符号表示);基态D原子的电子排布式为______。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____杂化;BC3-的立体构型为______(用文字描述)。
(3)1mol AB-中含有的π键个数为______。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______。
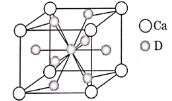
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。己知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中电离过程为:
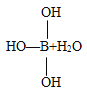
![]()
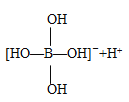
下列判断正确的是( )
A.凡是酸或碱对水的电离都是抑制的
B.硼酸是三元酸
C.硼酸溶液与NaOH溶液反应的离子方程式:H3BO3+OH-=[B(OH)4]-
D.硼酸是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盐酸和氯化铝的混合液中不断滴加氢氧化钠溶液,下列图象中,能正确表示上述反应的是(横坐标表示加入氢氧化钠溶液的体积,纵坐标表示反应生成沉淀的质量)( )
A. B.
B.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com