
| A. | 制氧气时,用Na2O2或H2O2作反应物选择相同的气体发生装置 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化和干燥气体 | |
| C. | 制氢气时,用浓硫酸与锌反应比用稀硫酸快 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
分析 A.用Na2O2或H2O2作反应物制备氧气都是利用固体和液体不和加热反应生成,据此选择装置;
B.氯气溶于水和水反应生成盐酸和次氯酸是化学平衡,盐酸和碳酸氢钠能发生反应促进平衡正向进行,不能制备氯气;
C.浓硫酸和锌反应不能生成氢气;
D.二氧化氮和水反应生成硝酸同时生成一氧化氮也是污染气体;
解答 解:A.用Na2O2或H2O2作反应物制备氧气都是利用固体和液体不和加热反应生成,应选择分液漏斗中的液体加入过氧化钠中反应或过氧化氢从分液漏斗中滴入固体二氧化锰催化作用发生反应生成氧气,应选择相同的气体发生装置,故A正确;
B.氯气溶于水和水反应生成盐酸和次氯酸是化学平衡,盐酸和碳酸氢钠能发生反应促进平衡正向进行,生成的氯气通过饱和NaHCO3溶液不能制得氯气,故B错误;
C.浓硫酸和锌反应不能生成氢气,实验室是用稀硫酸和锌反应生成氢气故C错误;
D.二氧化氮和水反应生成硝酸同时生成一氧化氮也是污染气体,不能被吸收,氢氧化钠溶液可以吸收二氧化氮气体,故D错误;
故选A.
点评 本题考查了气体制备、气体除杂、尾气处理等实验基础知识,掌握反应原理和实验基本操作是解题关键,题目难度中等.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
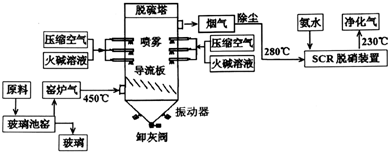
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
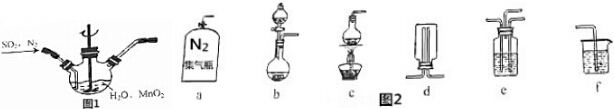
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2:电解饱和食盐水 | B. | O2:过氧化氢与二氧化锰混合 | ||
| C. | H2:锌粒和稀硝酸混合 | D. | NH3:氮气和氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
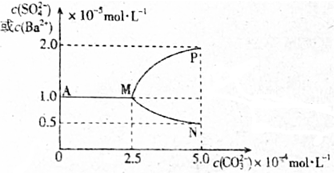
| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的化学式为Fe2O3 | |
| B. | x=6 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | 每生成1mol Y,反应转移的电子总数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂 | |
| B. | 反应的氧化产物只有氧气 | |
| C. | 当反应产生标准状况下2.24 L O2 时,反应转移的电子为0.1mol | |
| D. | 通常所说的酸化的高锰酸钾溶液是指滴加了浓盐酸的高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com