
| A. | 锌片溶解了1mol,铜片上析出1mol氢气 | |
| B. | 两极上溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1g,铜片上析出1g氢气 | |
| D. | 电解质溶液pH不变 |
分析 由铜、锌和稀硫酸组成的原电池,其中正极材料是铜,溶液中氢离子得到电子生成氢气,电极反应2H++2e-=H2↑,锌做负极失电子生成锌离子,电极反应为:Zn-2e-=Zn2+,电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,当导线中通过2mo1电子时,生成1mol气体,溶解1molZn,以此来解答.
解答 解:电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,当导线中通过2mo1电子时,生成1mol气体,溶解1molZn,
A.由上述分析可知,锌片溶解了1mol,铜片上析出1mol氢气,故A正确;
B.两极上溶解和析出的物质的质量分别为65g、2g,不相等,故B错误;
C.由选项B可知,锌片溶解了65g,铜片上析出2g氢气,故C错误;
D.氢离子浓度减小,pH增大,故D错误;
故选A.
点评 本题考查原电池及电极反应,为高频考点,把握发生的电极反应及物质的量的相关计算为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H6 | C. | C3H4 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
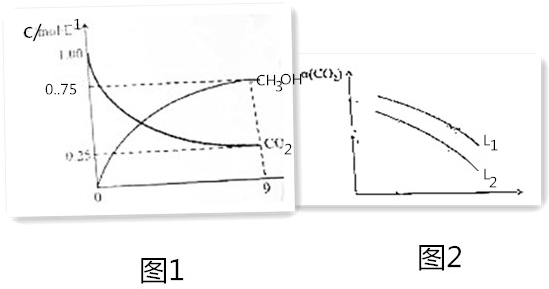
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
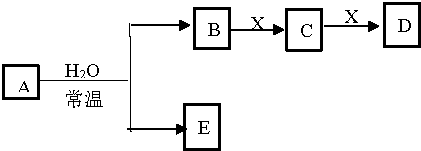
| A. | 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐 | |
| B. | 若X是Na2SO3,C是气体,则A可能是氯气,且D和E能发生反应 | |
| C. | 若D是CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种 | |
| D. | 若A是单质,B和D的反应是,则E一定能还原Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 无法确定硝酸的浓度 | B. | n(NO):n(NO2)=1:1 | ||
| C. | 4.8<m<12.8 | D. | 反应后c(NO${\;}_{3}^{-}$)=4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com