
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
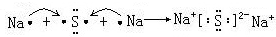 ,
,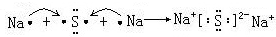 .
.


科目:高中化学 来源: 题型:
| A、实验室为了对配制好的溶液进行精确测定其浓度,一般选用高纯度、性质稳定、相对分子质量较大的物质做为基准物进行标定 |
| B、化学实验要注意控制条件,考虑反应物的浓度和用量,选择适宜的温度范围,以及是否要使用催化剂等 |
| C、倾析法适用于分离或洗涤结晶颗粒较大、静置后容易沉降至容器底部的沉淀 |
| D、火柴头的药粉中含有对空气敏感的易燃物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+,Na+,SO42-,NO3- |
| B、Ba2+,NH4+,OH-,MnO4- |
| C、H+,K+,Cl-,CO32- |
| D、Na+,Fe2+,NO3-,OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验 目的 |
检查装置气密性 | 实验室用纯碱和稀硫酸制备二氧化碳 | 用已知浓度的氢氧化钠溶液测定未知浓度盐酸 | 从碘的CCl4溶液中分离出碘 |
| 实验装置 |  |
 |
 |
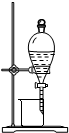 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2) |
| n(CO) |
| n(H2) |
| n(CO) |

| 温度 (℃) | 250 | 300 | 350 |
| 平衡常数(k) | 2.04 | 0.25 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
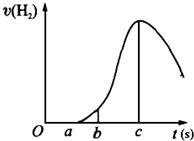 把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:
把在空气中久置的镁条7.2g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,镁条与硫酸反应产生氢气的速率与反应时间如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
24 12 |
7 3 |
14 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com