
【题目】I.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置。
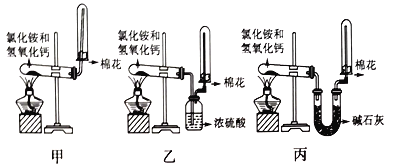
(1)写出实验室制氨气的化学反应方程式:_________________。
(2)实验室装置和所用样品都正确的是_________(填“甲”、“乙”、 “丙”)。
(3)检验试管里是否收集满了氨气的方法是:__________________。
(4)上述装置中,其中的一个装置肯定收集不到氨气的是_______,原因是(用化学方程式表示)___________________________。
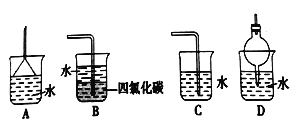
(5)尾气处理时: 选择不可以用于处理氨气的________。
(6)氨的催化氧化是工业制硝酸的基础反应,写出反应的化学方程式__________。
II. 将红热的固体单质甲放入显黄色的溶液乙中剧烈反应产生混合气体A,A 在常温下不与空气作用,有如下变化关系:
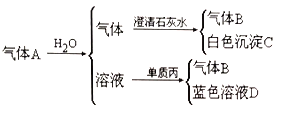
①推导出各物质的化学式B_______C________D________。
②写出甲跟乙反应的化学方程式:__________。A 溶于水发生的化学方程式__________。丙生成B 的离子方程式__________。
【答案】 Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O 丙 第一种方法是在试管口处放一块湿润的红色石蕊试纸,若试纸将变蓝色,则证明已经集满。第二种方法是:用玻璃棒蘸取浓盐酸或者浓硝酸,放在试管口,若产生大量白烟,则证明已经集满 乙 2NH3+H2SO4=(NH4)2SO4 C 4NH3+5O2
2NH3↑+CaCl2+2H2O 丙 第一种方法是在试管口处放一块湿润的红色石蕊试纸,若试纸将变蓝色,则证明已经集满。第二种方法是:用玻璃棒蘸取浓盐酸或者浓硝酸,放在试管口,若产生大量白烟,则证明已经集满 乙 2NH3+H2SO4=(NH4)2SO4 C 4NH3+5O2![]() 4NO+6H2O NO CaCO3 【答题空10】Cu(NO3)2 C+4HNO3(浓)
4NO+6H2O NO CaCO3 【答题空10】Cu(NO3)2 C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 3NO2+H2O=2HNO3+NO 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
CO2↑+4NO2↑+2H2O 3NO2+H2O=2HNO3+NO 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
【解析】I.(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气和水,方程式为Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O;(2)氨气为碱性气体,甲中没有干燥装置,得到的氨气中含有水蒸气;乙中浓硫酸能够与氨气发生反应,不能干燥浓硫酸;丙中,碱石灰为碱性干燥剂能够干燥氨气,因此实验室装置和所用样品都正确的是丙;(3)氨气为碱性气体,与水生成具有碱性的一水合氨,遇红色的湿润的石蕊试纸显蓝色;因此检验试管里是否收集满了氨气的方法是在试管口处放一块湿润的红色石蕊试纸,若试纸将变蓝色,则证明已经集满或者是用玻璃棒蘸取浓盐酸或者浓硝酸,放在试管口,若产生大量白烟,则证明已经集满;(4)氨气为碱性气体与硫酸反应生成硫酸铵,因此乙装置不能得到啊,反应的方程式为2NH3+H2SO4=(NH4)2SO4;(5)氨气极易溶于水,尾气处理时必须有防倒吸装置,即倒扣的漏斗或干燥管或者通入四氯化碳中使氨气与水不直接接触,即装置A、B、D均可以吸收尾气,C不可以,答案选C。(6)氨的催化氧化的化学方程式为4NH3+5O2
2NH3↑+CaCl2+2H2O;(2)氨气为碱性气体,甲中没有干燥装置,得到的氨气中含有水蒸气;乙中浓硫酸能够与氨气发生反应,不能干燥浓硫酸;丙中,碱石灰为碱性干燥剂能够干燥氨气,因此实验室装置和所用样品都正确的是丙;(3)氨气为碱性气体,与水生成具有碱性的一水合氨,遇红色的湿润的石蕊试纸显蓝色;因此检验试管里是否收集满了氨气的方法是在试管口处放一块湿润的红色石蕊试纸,若试纸将变蓝色,则证明已经集满或者是用玻璃棒蘸取浓盐酸或者浓硝酸,放在试管口,若产生大量白烟,则证明已经集满;(4)氨气为碱性气体与硫酸反应生成硫酸铵,因此乙装置不能得到啊,反应的方程式为2NH3+H2SO4=(NH4)2SO4;(5)氨气极易溶于水,尾气处理时必须有防倒吸装置,即倒扣的漏斗或干燥管或者通入四氯化碳中使氨气与水不直接接触,即装置A、B、D均可以吸收尾气,C不可以,答案选C。(6)氨的催化氧化的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
II.①单质丙和A与水反应后的溶液发生反应生成蓝色溶液,则该蓝色溶液中含有铜离子,气体A和水反应生成的溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则A与水反应后的溶液中含有HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,根据以上分析知,甲、乙、丙分别是:C、HNO3(浓)、Cu,A为CO2、NO2,B为NO,C为CaCO3,D为Cu(NO3)2;②甲与乙反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,A溶于水发生的化学方程式为3NO2+H2O=2HNO3+NO。丙生成B的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O。
CO2↑+4NO2↑+2H2O,A溶于水发生的化学方程式为3NO2+H2O=2HNO3+NO。丙生成B的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】甲酸钠广泛用作催化剂和稳定合成剂,印染行业的还原剂,还可用于生产保险粉、草酸和甲酸.用电石炉废气(CO75%~90%,以及少量CO2、H2S、N2、CH4等),其合成部分工艺流程如下: 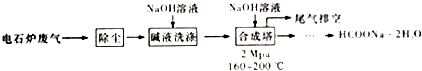
(1)上述工艺用碱液洗涤的目的是 , 可能发生的反应有(列举两利).
(2)上述合成工艺中采用循环喷射吸收合成,其目的是;最后尾气主要成分是 .
(3)合成时,得到的HCOONa溶液溶质质量分数约为5%,合成塔反应液中分离出HCOONa2H2O 的主要步骤有、、过滤,再经洗涤干燥得到.
(4)甲酸钠高温时分解制取草酸钠的化学方程式为 .
(5)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组液体混合物:①汽油和氯化钠溶液 ②乙醇与水 ③单质溴和水,分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验装置用于验证NaHCO3的稳定性,做了如下下实验。D为固定蚊香的硬纸片。试回答下列问题:

(1)在A试管内发生反应的化学方程式是_________________________。
(2)在双球干燥管内发生反应的化学方程式为_______________________________。
(3)双球干燥管内观察到的实验现象是_________________________。通过上面的实验现象某同学受到启发用如图所示装置制取纯净的氧气.试回答下列问题:
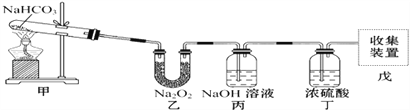
(4)丙中NaOH溶液的作用是______________,丁中浓硫酸的作用是____________。
(5)若把原装置连接顺序改为甲→丙→乙→丁→戊,则在装置戊中能否收集到氧气?____(填“能”或“不能”),原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮的固定的说法错误的是
A.氮的固定包括人工固氮和自然固氮
B.工业合成氨属于人工固氮
C.自然固氮中氮元素被氧化
D.氮的的固定中参与元素至少有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Cu、Fe、Cl、O、N是常见的6种元素.
(1)Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .
(2)用“>”或“<”填空:
第一电离能 | 原子半径 | 稳定性 |
NO | CNa | NH3H2O |
(3)液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:
(4)古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下面叙述正确的是( )
A. 标准状况下,11.2L CCl4所含分子数为0.5NA
B. 1L 1mol/L的氯化钠溶液中,所含离子数为NA
C. 常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3NA
D. 1mol Cl2与足量的铁发生反应,转移的电子总数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com