
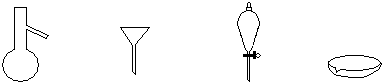
| A. | 蒸馏、蒸发、分液、过滤 | B. | 蒸馏、过滤、分液、蒸发 | ||
| C. | 萃取、过滤、蒸馏、蒸发 | D. | 过滤、蒸发、萃取、蒸馏 |
分析 蒸馏烧瓶用于分离沸点相差较大的两种液体的分离或难挥发性固体和液体的分离;
普通漏斗用于分离互不相溶的固体和液体;
分液漏斗用来分离互不相溶的液体或分离在不同溶剂中溶解度不同的混合物;
蒸发皿用于可溶性固体和液体的分离,以此来解答.
解答 解:蒸馏烧瓶用于分离沸点相差较大的两种液体的分离或难挥发性固体和液体的分离,即蒸馏;
普通漏斗用于分离互不相溶的固体和液体,即过滤;
分液漏斗用来分离互不相溶的液体或用来分离在不同溶剂中溶解度不同的混合物,即分液或萃取;
蒸发皿用于可溶性固体和液体的分离,即蒸发,
所以从左至右,可以进行的混合物分离操作分别是:蒸馏、过滤、分液或萃取、蒸发,
故选B.
点评 本题考查混合物分离提纯及实验仪器等,为高频考点,把握常见的仪器及用途等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 纯水中水的电离:2H2O?H3O++OH- | |
| C. | 氢硫酸的电离:H2S?2H++S2- | |
| D. | 氯化铁和硫氰化钾反应:Fe3++3SCN-?Fe(SCN)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用激光笔照射稀豆浆,有丁达尔效应,稀豆浆属于胶体 | |
| C. | 用盐酸溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用分液漏斗分离水与乙醇的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种难溶盐电解质,其中Ksp小的溶解度一定小 | |
| B. | 溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀 | |
| C. | 难溶盐电解质的Ksp与温度有关 | |
| D. | 同离子效应使难溶盐电解质的溶解度变小,也使Ksp变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强弱电解质的根本区别在于电离时是否存在电离平衡 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 弱电解质的水溶液中只有离子,没有分子 | |
| D. | 强电解质融化状态下都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | FeCl2在空气中被氧化 4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | AlCl3溶液中通入过量的NH3:Al3++4NH3•H2O=AlO2-+4NH4+ | |
| D. | FeBr2 (aq) 中通入少量Cl2 2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com