
| A. | FeCl2有氧化性,能用于雕刻电路板 | |
| B. | 金刚石是自然界中硬度最大的物质,不与氧气发生反应 | |
| C. | 明矾加入水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | SiO2不与强酸反应,可用石英器皿盛装氢氟酸 |
分析 A.氯化亚铁和铜不发生反应;
B.金刚石是碳的单质,和氧气反应生成二氧化碳;
C.明矾溶解后溶液中铝离子水解生成氢氧化铝胶体具有吸附作用;
D.二氧化硅和氢氟酸发生反应.
解答 解:A.FeCl2有氧化性,不和铜反应不能用于雕刻电路板,是利用氯化铁的氧化性和铜反应雕刻电路板,故A错误;
B.金刚石是自然界中硬度最大的物质,金刚石是碳的单质,和氧气反应生成二氧化碳,故B错误;
C.明矾加入水中能形成Al(OH)3胶体,具有较大表面积吸附悬浮杂质可用作净水剂,故C正确;
D.SiO2不与强酸反应,但和氢氟酸反应,不可用石英器皿盛装氢氟酸,故D错误;
故选C.
点评 本题考查了铁、碳、铝硅及其化合物性质分析应用,注意知识积累,掌握基础是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl 的电子式: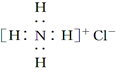 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 用电子式表示氧化钠的形成过程: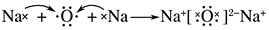 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人工合成的硅橡胶是目前最好的既耐高温又耐低温的橡胶 | |
| B. | 肥皂水显碱性,可用作蚊虫叮咬处的清洗剂 | |
| C. | 明矾净水是因为明矾水解产生的氢氧化铝胶体可以吸附水里悬浮的杂质 | |
| D. | 铝比铁更活泼,铁制品比铝制品更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
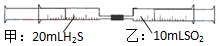 常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )
常温下,将甲针筒内20mLH2S推入含有10mLSO2的乙针筒内,一段时间后,对乙针筒内现象描述错误的是(气体在同温同压下测定)( )| A. | 有淡黄色固体生成 | B. | 有无色液体生成 | ||
| C. | 气体体积缩小 | D. | 最终约余15mL气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
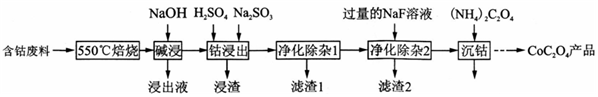
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
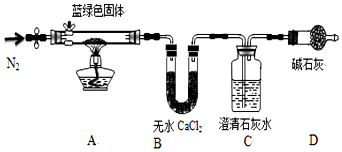
| 溶解度(s)/g | 溶度积(Ksp) | 摩尔质量(M)g/mol | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
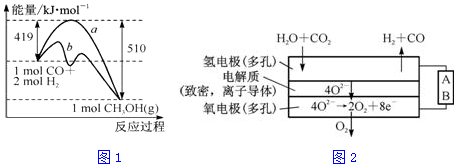
| 离子 | Cu2+ | H+ | Cl- | SO42 - |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com