
【题目】LiFePO4电池具有稳定性高、安全、对环境友好等优点.某电极的工作原理如图1所示,该电池电解质为能传导 Li+的固体材料.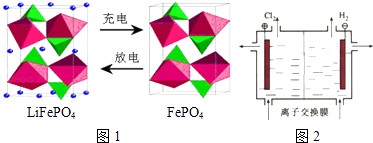
(1)放电时,该电极为极,电极反应为
(2)充电时该电极连接外接电源的极
(3)放电时,电池负极的质量(减少、增加、不变)
(4)LiOH可做制备锂离子电池电极的材料,利用如图2装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.阴极区电解液为溶液(填化学式),离子交换膜应使用(阳、阴)离子交换膜.
【答案】
(1)正;FePO4+e﹣+Li+=LiFePO4
(2)正
(3)减少
(4)LiOH;阳
【解析】解:(1)放电时,该装置是原电池,Fe元素化合价由+3价变为+2价,得电子发生还原反应,所以该电极是正极,电极反应式为FePO4+e﹣+Li+=LiFePO4 , 所以答案是:正;FePO4+e﹣+Li+=LiFePO4;(2)充电时LiFePO4生成FePO4 , 被氧化,应连接电源的正极,所以答案是:正极;(3)放电时,FePO4被还原而消耗,则电极质量减少,所以答案是:减少;(4)电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液,由图可知,右侧生成氢气,则氢离子放电,可知为阴极,制备LiOH,Li+由左侧经过阳离子交换膜向右侧电极移动,应为阳离子交换膜,所以答案是:LiOH;阳.


科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的浓度关系正确的是( )
A.1.0 mol/L Na2C2O4溶液中:c(OH﹣)═c(H+)+c(HC2O ![]() )+2c(H2C2O4)
)+2c(H2C2O4)
B.含等物质的量的NaHCO3和Na2CO3的溶液中:3c(Na+)=2[c(HCO ![]() )+c(CO
)+c(CO ![]() )+c(H2CO3)]
)+c(H2CO3)]
C.二元酸H2A在水中发生电离:H2A=H++HA﹣和HA﹣?H++A2﹣ , 则NaHA溶液中:c(Na+)>c(HA﹣)>c(OH﹣)>c(H+)
D.含有AgCl和AgI固体的悬浊液:c(Cl﹣)<c(I﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质.实验室灼烧海带应放在(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是 .
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I﹣ , 制得富碘溶液.实验室模拟氧化过程的实验装置如图所示.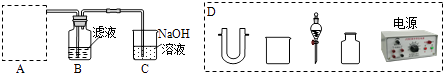
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl﹣;二是电解法.限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是(选填编号).
a.2NaCl(s)+MnO2+2H2SO4(浓) ![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O ![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是 . 装置C中NaOH的作用是 .
(3)步骤三:取100mL B中富碘溶液,按如下流程分离碘单质.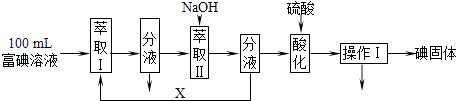
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH﹣→5I﹣+IO3﹣+3H2O;
5I﹣+IO3﹣+6H+→3I2+3H2O;
萃取剂X应选择(选填编号).
a.100mL苯b.10mL乙醇c.10mLCCl4d.10mL己烯
实验室进行萃取操作的仪器是 . 操作Ⅰ的名称是 .
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是(填写化学式);
②要测定的物理量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( ) 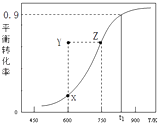
A.脱氢反应的△H<0
B.在t1K时,该反应的平衡常数为8.1
C.600K时,Y点甲醇的υ(正)<υ(逆)
D.若增大体系压强,曲线将向上平移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物分离提纯的方法正确的是 ( )
A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2
B.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
C.除去乙醇中的微量水可加入金属钠,使其完全反应
D.乙烯中混有CO2和SO2 , 将其通过盛有NaOH溶液的洗气瓶,再干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是 ( )
A. 氨气通入稀硫酸中:NH3+H+=NH4+
B. 二氧化碳通入碳酸钠溶液中:CO2+CO![]() +H2O=2HCO3-
+H2O=2HCO3-
C. 磁性氧化铁与浓盐酸反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
D. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO![]() ===CaCO3↓+H2O
===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ ![]() O2(g)=CO(g);△H=﹣393.5 kJ/mol
O2(g)=CO(g);△H=﹣393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3 kJ
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=﹣1400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=﹣1400 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).
请填写下列空白: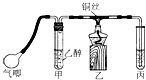
(1)检验乙醛的试剂是;(选填编号)
a.银氨溶液 b.碳酸氢钠溶液 c.新制氢氧化铜 d.氧化铜
乙醇发生催化氧化的化学反应方程式为;
(2)实验开始时,是先鼓入空气还是先点燃酒精灯加热铜丝? , 原因是;该实验中“鼓气速度”这一变量你认为可用来估量;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 . 以下实验需要水浴加热的是;(选填编号)
a.卤代烃水解 b.银镜反应 c.乙酸丁酯 d.苯的硝化反应
(4)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色(假设两者恰好完全反应).该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确? .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com