
分析 (1)在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,2分钟末反应达到平衡状态,生成了0.8mol D,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
(2)反应气体气体体积不变,用物质的量代替浓度代入K=$\frac{{c}^{2}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$计算平衡常数;
(3)转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(4)若维持温度不变,将容器体积压缩至1L,压强增大,反应气体气体分子数目不变,平衡不移动.
解答 解:(1)在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,2分钟末反应达到平衡状态,生成了0.8mol D,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
故答案为:起始量:2mol 2mol 0mol 0mol
变化量:1.2mol 0.4mol 0.8mol 0.8mol
平衡量:0.8mol 1.6mol 0.8mol 0.8mol
(2)反应气体气体体积不变,用物质的量代替浓度计算平衡常数,故K=$\frac{{c}^{2}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$=$\frac{0.{8}^{2}×0.{8}^{2}}{0.{8}^{3}×0.12}$=0.75,
答:此温度下该反应的平衡常数是0.75;
(3)A的转化率=$\frac{1.2mol}{2mol}$×100%=60%,
答:A的转化率为60%;
(4)若维持温度不变,将容器体积压缩至1L,压强增大,反应气体气体分子数目不变,平衡不移动,则A的转化率不变,
故答案为:不变;维持温度不变,将容器体积压缩至1L,压强增大,反应气体气体分子数目不变,平衡不移动.
点评 本题考查化学平衡有关计算与影响因素,比较基础,注意三段式解题法在化学平衡计算中应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
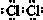 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2NaOH=Na2SiO3+H2O | |
| B. | 苯酚钠溶液中通入少量CO2:2 +CO2+H2O→2 +CO2+H2O→2 +HCO3- +HCO3- | |
| C. | 碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-═NH3↑+H2O | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液与小苏打溶液反应:OH-+HCO3-═H2O+CO2↑ | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2 | |
| C. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O═O2↑+4OH-+4Na+ | |
| D. | 向Cl2水中滴入适量FeCl2 溶液,溶液变为黄色:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S2O3稀溶液中加入稀硫酸,发生如下反应:S2O32-+2H+=SO2↑+S↓+H2O,利用产生浑浊的快慢或产生气泡的快慢可以测定该反应在不同条件下的反应速率 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀,这说明铁钉发生了吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 5:1 | C. | 1:3 | D. | 1:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com