
(10分)已知:用惰性电极电解某盐X的溶液,发生的反应为:
X+H2O  A(单质)+B(单质)+Y(化合物)
A(单质)+B(单质)+Y(化合物)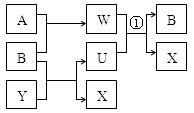
(1)若组成X的元素均为短周期元素,且A、B均为气体,其在相同条件下体积 比为1:1,产物之间可以发生如图的反应(变化中的水略去)。写出有关反应的离子反应方程式:①_______________________________。
(2)若A为红色固体,A可以与Y的浓溶液反应生成一种与A的摩尔质量相同的气体。
①写出该电解过程中阳极的电极反应式:___________________;
②某学生电解一定浓度的X溶液一段时间后,向所得溶液中加入0.1molACO3后,恢复到电解前的浓度和pH(不考虑CO2溶解),则电解过程中转移的电子数为_______。
(3)若向X的溶液中加入过量的稀盐酸,产生白色沉淀,且存在如下的转化关系:
Ⅰ. A+Y(浓)→X+C(气体)+H2O;Ⅱ. A+Y(稀)→X+D(气体)+H2O;Ⅲ. M+O2→D(气体)+H2O。
①已知:组成M气体的两种元素质量比为14:3,则检验M的方法是___________________;
②在标准状况下,27gA溶于一定浓度的Y溶液时,产生2.8L气体,将装有该气体的量筒倒立于有水的水槽中,再通入_______L气体B,水才能恰好充满量筒。
(1)① Cl-+ClO-+2H+=Cl2↑+H2O;(2)①4OH--4e-=2H2O+O2↑;②0.2NA或1.204×1023 ;
(3)①用湿润的红色石蕊试纸靠近盛M的集气瓶口,试纸若变蓝,则证明是NH3;②1.4L。
解析试题分析:(1)①根据题意可知:X是NaCl,A是H2;B是Cl2;Y是NaOH;U是NaClO;W是HCl;①反应的离子反应方程式是:Cl-+ClO-+2H+=Cl2↑+H2O;(2)若A为红色固体,A可以与Y的浓溶液反应生成一种与A的摩尔质量相同的气体。则A是Cu,Y是浓硫酸,X是CuSO4;①在该电解CuSO4溶液的过程中,由于OH-放电能力大于SO42-,所以在阳极放电的是OH-,阳极的电极反应式是:4OH--4e-=2H2O+O2↑;②某学生电解一定浓度的X溶液一段时间后,向所得溶液中加入0.1molCuCO3后,恢复到电解前的浓度和pH(不考虑CO2溶解),则由于0.1molCuCO3能够发生反应消耗0.1mol的硫酸,根据电解反应方程式2CuSO4+2H2O 2Cu+O2↑+2H2SO4可知:电解过程中产生0.1mol的硫酸,转移的电子数为0.2NA。(3)根据题意可知:X是AgNO3;Y是HNO3;A是Ag;B是O2;C是NO2;D是NO ; M是NH3,①已知:组成M气体的两种元素质量比为14:3,则M是NH3,检验M的方法是用湿润的红色石蕊试纸靠近盛M的集气瓶口,试纸若变蓝,则证明是NH3;②在标准状况下,27gAg的物质的量是 27g÷108g/mol=0.25mol,溶于一定浓度的Y溶液时,产生2.8L NO2与NO的混合气体,将装有该气体的量筒倒立于有水的水槽中,再通入一定气体B,水才能恰好充满量筒。则在反应过程中Ag失去的电子与氧气得到的电子的物质的量相等。则(v/22.4)×4=0.25;解得V=1.4L。
2Cu+O2↑+2H2SO4可知:电解过程中产生0.1mol的硫酸,转移的电子数为0.2NA。(3)根据题意可知:X是AgNO3;Y是HNO3;A是Ag;B是O2;C是NO2;D是NO ; M是NH3,①已知:组成M气体的两种元素质量比为14:3,则M是NH3,检验M的方法是用湿润的红色石蕊试纸靠近盛M的集气瓶口,试纸若变蓝,则证明是NH3;②在标准状况下,27gAg的物质的量是 27g÷108g/mol=0.25mol,溶于一定浓度的Y溶液时,产生2.8L NO2与NO的混合气体,将装有该气体的量筒倒立于有水的水槽中,再通入一定气体B,水才能恰好充满量筒。则在反应过程中Ag失去的电子与氧气得到的电子的物质的量相等。则(v/22.4)×4=0.25;解得V=1.4L。
考点:考查元素及化合物的推断、物质的性质、转化、气体的检验、守恒方法在计算中的应用的知识。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:单选题
根据 ,下列说法不正确是
,下列说法不正确是
①X一定是单质;
②反应Ⅱ一定是化合反应;
③若强酸为HNO3,氧化物一定是酸性氧化物;
④若强碱为NaOH,氧化物一定是Na2O。
| A.①③ | B.②③ | C.②③④ | D.全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中学化学中,常见无机物A、B、C、D、E、X、Y存在如下图转化关系(部分生成物和反应条件略去)。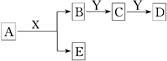
下列推断正确的是
A.若A是CaC2,X是H2O,则Y一定是溴水
B.若A是金属钠,X是H2O,则E一定能还原Fe2O3
C.若Y是NaOH,C是白色沉淀,则A与X一定发生置换反应
D.若Y是氧气,D是氧化物,则A与X一定发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是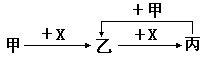
| A.甲为C,X是O2 | B.甲为SO2,X是NaOH溶液 |
| C.甲为Cl2,X为Fe | D.甲为Al,X为NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)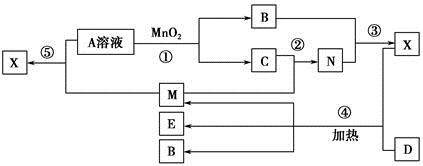
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为___________________________
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adeb C.abcbd D.abd
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面是有关物质的转化关系图,其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。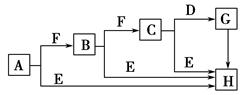
(1)下列对C的结构、性质推断中不正确的是 ( )。
| A.久置于空气中会变成白色 |
| B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 |
| D.是一种碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下图所示进行反应,又知E溶液是无色的。请回答: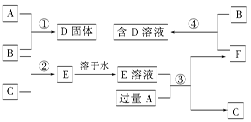
(1)A是 ,B是 ,C是 。(请填化学式)
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
几种中学化学常见的单质及其化合物相互转化的关系图如下: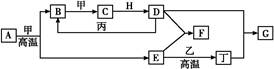
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。A、E、F、G四种物质中含同种元素。
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为 ,每反应1 mol的A转移的电子为 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式: ;
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。
试将①、②、③三个序号以及对应的分散质具体的化学式填入下列方框中:
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示(某产物已略去):
已知:B、X为单质,常温下D为无色液体,A、B含同一种元素。
请回答下列问题:
(1)若E气体是大气污染物,F是一元强酸。
①写出E→F反应的化学方程式: 。
②现有25℃时0.1 mol·L-1 A的水溶液,若向其中加入等体积0.1 mol·L-1的稀硫酸,则所得溶液中各离子的物质的量浓度由大到小的顺序是 。
③在常温下,向V1 L pH=a的A的水溶液中加入V2 L pH=b的盐酸,且a+b=14,若恰好完全反应,则V1和V2的关系为Vl V2(填“>”、“<”、“=”或“无法确定”),等pH的所得溶液与盐酸比较,由水电离出的c(H+)前者为后者的108倍,则两种溶液的pH= 。
(2)若E气体不是大气污染物,F是二元弱酸。
①B所含元素在周期表中的位置 。
②写出氧化铁与C反应的化学方程式: ;将少量气体E通入氢氧化钙溶液中得不溶物F,F的Ksp=2.8×10-9。现将该沉淀放入0.1 mol·L-1的CaCl2溶液中,其Ksp (填“增大”、“减小”或“不变”),此时,组成不溶物F的阴离子在溶液中的浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com