
| A. | H、D、T表示三种氢原子 | |
| B. | 卤族元素最高化合价均为正7价,最低化合价均为负1价 | |
| C. | 金属元素的原子最外层电子数,都少于4个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
科目:高中化学 来源: 题型:选择题
| A. | X的金属性比Y的金属性强 | |
| B. | 常温下,X和Y都不能从水中置换出氢 | |
| C. | Y元素的氢氧化物碱性比X 元素的氢氧化物碱性强 | |
| D. | X元素的最高化合价比Y 元素的最高化合价低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
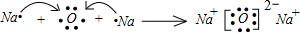
 或
或

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2和H2O2 | B. | KOH和H2SO4 | C. | CCl4和KCl | D. | MgCl2和Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质A的转化率大了 | B. | a<b | ||
| C. | 物质B的质量分数减小了 | D. | 平衡向正反应方向移动了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com