
| A. | 次氯酸的电子式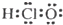 | B. | 氟化氢的电子式: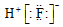 | C. | OH-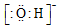 | D. | 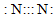 |
分析 A.次氯酸的中心原子为O原子,分子中不存在Cl-O键;
B.氟化氢为共价化合物,分子中不存在阴阳离子;
C.氢氧根离子为复杂阴离子,电子式中需要标出所带电荷及最外层电子;
D.该电子式中的氮氮三键的表示方法错误.
解答 解:A.次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,其正确的电子式为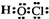 ,故A错误;
,故A错误;
B.氟化氢为共价化合物,分子中存在1个F-H共价键,氟化氢正确的电子式为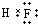 ,故B错误;
,故B错误;
C.氢氧根离子带有1个单位负电荷,其电子式为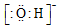 ,故C正确;
,故C正确;
D.氮气分子中存在氮氮三键,氮原子最外层为8电子,N2正确的电子式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,侧重考查离子化合物、共价化合物的电子式的书写方法,明确电子式的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:多选题
| A. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 | |
| B. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| C. | 容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | |
| D. | 容器Ⅰ、Ⅱ中正反应速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在镀件上电镀铜时,可用金属铜作阳极 | |
| B. | 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀 | |
| C. | 工业上电解饱和食盐水制烧碱,NaOH在阴极产生 | |
| D. | 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2mol•L-1的 Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)] | |
| B. | 浓度相等的a、NH4HSO4溶液、b、NH4HCO3溶液、c、NH4Cl溶液中的c(NH4+):a>b>c | |
| C. | NaHSO3溶液显酸性,c(Na+)>c(HSO3- )>c(H+)>c(OH-)>c(SO32-) | |
| D. | pH=3.6 的0.lmol/LHX 与0.lmol/LNaX 的混合溶液中,2c(H+)-2c(OH-)=c(X-)-c(HX) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.12 g | B. | 4.24 g | C. | 3.18 g | D. | 5.28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
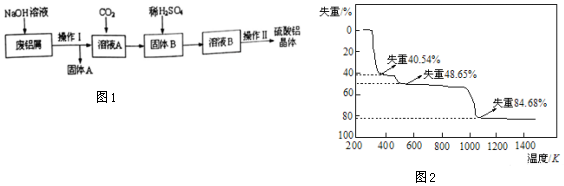
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{1}$H(氕)、${\;}_{\;}^{2}$H(氘)、${\;}_{\;}^{3}$H(氚)是三种氢元素 | |
| B. | 所有氢元素粒子的核外都只有一个电子 | |
| C. | 所有氢元素粒子的化学性质都相同 | |
| D. | 能用符号H表示的原子在元素周期表中的位置相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com