
Ag2SO4溶解度较小,25℃时,每100 g水仅溶解0.836 g.
(1)25℃时,在烧杯中加入6.24 g Ag2SO4固体,加200g水,经充分溶解后,所得饱和溶液的体积为200 mL,计算溶液中Ag+的物质的量浓度.
(2)在上述烧杯中需加入多少升0.0268 mol•L-1BaCl2溶液,才能使原溶液中Ag+浓度降至0.02 mol·L-1?
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| A | B | |
| C | D |
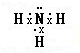
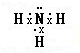
| 化学键 | H-H | Br-Br | H-Br |
| 能量(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)25℃时,在烧杯中加入6.24 g Ag2SO4固体,加200g水,经充分溶解后,所得饱和溶液的体积为200 mL,计算溶液中Ag+的物质的量浓度.
(2)在上述烧杯中需加入多少升0.0268 mol•L-1BaCl2溶液,才能使原溶液中Ag+浓度降至0.02 mol·L-1?
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高二化学 山东科学技术出版社 鲁教版 题型:058
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥.某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下:
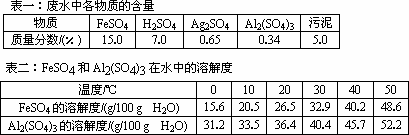
该课题组根据表中数据,设计了无水处理方案,拟利用该厂的废铁屑(有少量锈斑).烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag.
(1)请填写下列空白,完成得到Ag的实验方案:
①将有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是________.
②将工厂的废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用.
③________,目的是使Ag+全部还原为金属Ag.
④________,目的是分离出金属Ag.
(2)请写出后续的步骤,除去Al3+,得到比较纯净的FeSO4·7H2O晶体
⑤将第________步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4,________滤出FeSO4·7H2O晶体
⑥________,得到较纯净的FeSO4·7H2O晶体.
(3)步骤②中能否用普通自来水洗涤滤渣?________(填“能”或“否”)理由是________.
(4)步骤③中有关反应的离子方程式是________.
(5)在步骤⑤中,加少量硫酸调整溶液pH的目的是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com