
分析 (1)氯化铵与熟石灰反应生成氯化钙、水、氨气;
(2)n(NH4Cl)=$\frac{10.7g}{53.5g/mol}$=0.2mol,由N原子守恒可知,生成氨气为0.2mol;
(3)氨可以把一氧化氮还原成氮气,还生成水,只有N元素的化合价变化,以此来解答.
解答 解:(1)氯化铵固体与足量熟石灰混合加热,发生反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
(2)n(NH4Cl)=$\frac{10.7g}{53.5g/mol}$=0.2mol,由N原子守恒可知,生成氨气为0.2mol,其标准状况下体积为0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(3)氨可以把一氧化氮还原成氮气,反应的化学方程式为4NH3 +6NO═5N2 +6H2O,由N元素的化合价变化可知,4molN失去电子等于6molN得到电子,氧化产物与还原产物均为氮气,此反应中氧化产物与还原产物的物质的量之比为2:3,
故答案为:4NH3 +6NO═5N2 +6H2O;2:3.
点评 本题考查化学反应的计算,为高频考点,把握发生的反应、物质的量计算、反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意原子守恒的应用,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:实验题
 实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
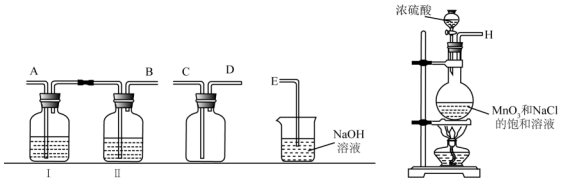
| 操作 | 现象 |
| 取漂粉精固体,加入水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的PH | 试纸先变蓝(约为12),后褪色 |
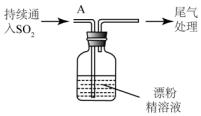 | i.液面上方出现雾状物 ii.稍后,出现浑浊,溶液变为黄绿色 iii.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可向稀硫酸中滴加少量硝酸铜溶液 | |
| B. | 可用勒夏特列原理解释2NO2(g)?N2O4(g)体系加压后颜色变深 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0可通过加压方式增大其平衡常数 | |
| D. | 二氧化硫和乙烯两种气体分别通入Br2的CCl4溶液,能使溶液褪色的是乙烯气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜水果多属于碱性食物,对人体健康有益 | |
| B. | 棉花、合成橡胶都属于合成材料 | |
| C. | 蚕丝、羊毛完全燃烧只生成CO2和H2O | |
| D. | 苯、植物油均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com