
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是
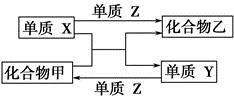
选项 | X | Y | Z | 甲 | 乙 |
A | H2 | Si | Cl2 | SiCl4 | HCl |
B | Mg | C | O2 | CO2 | MgO |
C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
D | Cl2 | N2 | H2 | NH3 | HCl |
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
化学与生产、生活密切相关,下列叙述正确的是
A.淀粉、油脂和蛋白质都是天然高分子化合物
B.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C.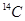 可用于文物年代的鉴定,
可用于文物年代的鉴定,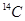 与
与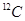 互为同素异形体
互为同素异形体
D.从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式正误判断(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=NO3-+NO+2H+
C.醋酸溶液水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaI溶液:K+、H+、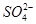 、
、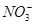
B.0.1 mol·L-1的NaHCO3溶液:K+、Na+、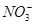 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、Na+、ClO-、Cl-
D.0.1 mol·L-1的氨水:Cu2+、Na+、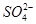 、
、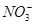
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学碳及其化合物主要性质(解析版) 题型:选择题
下列过程中,没有明显现象变化的是
A.向饱和碳酸钠溶液中通入CO2气体
B.SO3通入BaCl2溶液中
C.向碳酸氢钠溶液中滴加氢氧化钠溶液
D.向Fe(NO3)2溶液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)===2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:选择题
将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
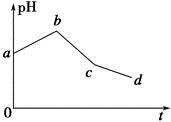
A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为 ,N—N键的键角为 。
(2)基态砷原子的最外层电子排布式为 。
(3)电负性是用来表示两个不同原子形成化学键时吸引键合电子能力的相对强弱,是元素的原子在分子中吸引共用电子对的能力。由此判断N、P、As、Sb的电负性从大到小的顺序是 。
(4)联氨(N2H4)可以表示为H2N—NH2,其中氮原子采用的轨道杂化方式为 ,联氨的碱性比氨的碱性 (填“强”或“弱”),其原因是 。
写出N2H4与N2O4反应的化学方程式: 。
(5)元素X与N同周期,且X的原子半径是该周期主族元素原子半径中最小的,X与Ca形成的化合物CaX2的晶胞结构如图所示:
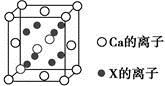
CaX2的晶体类型是 ,一个晶胞中含有Ca的离子数为 ,含有X的离子数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com