
“侯氏制碱法”是我国化工行业历史长河中一颗璀璨明珠。
Ⅰ..纯碱的制备:用下图装置制取碳酸氢钠,再间接制得纯碱。
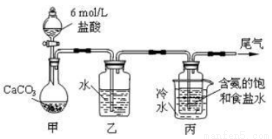
(1)装置乙的作用是 _________________,其中水可以用_______________代替;
(2)装置丙中反应的化学方程式为_____________________________________;
(3)用装置丙中产生的碳酸氢钠制取纯碱时,需要的实验操作有:_____________。
(4)定量分析:测定纯碱样品纯度
提供药品:酚酞、甲基橙、0.1mol/LHCl溶液
实验步骤:
①称取样品mg,溶于水形成100mL溶液;
②向溶液中滴加少量___________作指示剂,再向其中滴加盐酸溶液至终点,消耗盐酸_________VmL;
③计算:纯碱样品纯度=__________________。
Ⅱ.某小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去。为探究原因,进行了下列实验:加热0.1mol/LNaHCO3溶液,测得溶液pH随温度变化的曲线:
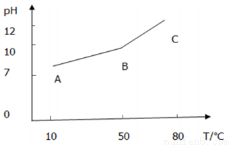
当温度恢复到10℃,测得溶液 pH=11.5。
(5)依据图像信息对下列问题做出合理猜测:
①AB段pH上升原因:____________________________________________________,
②BC段pH上升原因:____________________________________________________;
(6)设计实验对BC段pH上升的合理猜测进行验证(药品任意选择):__________________________。
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
近来,科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O2→2CO2+3H2O.下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1mol乙醇被氧化转移6mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极得电子的物质是O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下第二次月考化学试卷(解析版) 题型:选择题
橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下
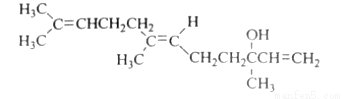
下列关于橙花醇的叙述,正确的是
A.橙花醇的分子式为C15H24O
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.在一定条件下能发生取代、催化氧化、酯化、加聚反应
D.0.1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗0.3mo1Br2
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春十一高三下考前冲刺理综化学试卷二(解析版) 题型:选择题
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:推断题
氯吡格雷(clopidogrel)是一种用于抑制血小板聚集的药物,其合成路线如下:

请回答下列问题:
(1)A的名称为______,C中含有的官能团有(写名称)_________________,
(2)C→D 的反应类型是______反应,X 的结构简式为_____________________,
(3)B中处在同一平面上的原子最多有______________个;
(4)若两分子C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环,则该反应的化学方程式是________________;
(5)写出符合下列条件的C的同分异构体的结构简式:_________________
a.为芳香族化合物且分子结构中含一个硝基(—NO2)
b.核磁共振氢谱有四组峰,且面积之比为 1:1:1:1
(6)已知: 写出由乙烯-甲醇为有机原料制备化合物
写出由乙烯-甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三毕业班最后一卷理综化学试卷(解析版) 题型:选择题
部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法不正确的是( )
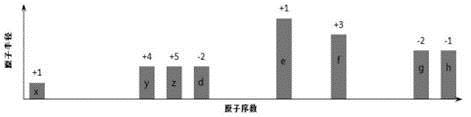
A. 简单离子半径的大小顺序g>h>e>f
B. 与x 形成化合物的沸点:d>z>y
C. zh3中各原子均满足8电子结构
D. x、y、z、d四种元素各自最高价和最低价代数和分别为0、0、2、4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:简答题
CO2加氢合成甲醇的技术,对减少温室气体排放和减缓燃料危机具有重要意义,发生的主要反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
回答下列问题:
(1)已知:H2和CH3OH的燃烧热分别为-285.8kJ·mol-1,-726.51kJ·mol-1;以及H2O(l)=H2O(g) △H=+44kJ·mol-1;则该反应的△H=________________;
(2)该反应的平衡常数表达式为________________;
(3)在350℃时,体积为0.5L的密闭容器中,充入1molCO2和3molH2发生上述反应,测定出CH3OH的体积分数随时间变化的曲线如图所示:

①能判断该反应达到化学平衡状态的依据是__________________;
A.容器内压强不变 B.H2的体积分数不变 C.c(CH3OH)=c(H2O) D.容器内密度不变
②氢气在0~10min的平衡反应速率v(H2)=_________________________;
③在右图中标出400℃时CH3OH的体积分数随时间变化的曲线。
(4)科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料用于军事目的。一种甲醇燃料电池是采用铂或碳化钨作电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向另一个电极通入空气。试回答下列问题:

①这种电池放电时,b处通入______________,发生的电极反应方程式是_____________________。
②若电解液中的3molH+通过质子交换膜,则消耗甲醇__________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下期中化学试卷(解析版) 题型:计算题
可逆反应2A(g)+B(g)  C(g),经过10s后,A的浓度为2mol.L-1,在此同时,B的浓度降低了0.06 mol.L-1..
C(g),经过10s后,A的浓度为2mol.L-1,在此同时,B的浓度降低了0.06 mol.L-1..
(1)A的起始浓度为多少?
(2)10 s内用A的物质浓度变化表示的反应速率是多少?
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下第二次月考化学试卷(解析版) 题型:选择题
A、B属于短周期元素,A的阳离子与B的阴离子具有相同的电子层结构。以下关于A、B的比较中,不正确的是( )
A. 原子半径:A<B B. 原子序数:A>B
C. 原子最外层电子数:B>A D. 元素所在的周期数:A>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com