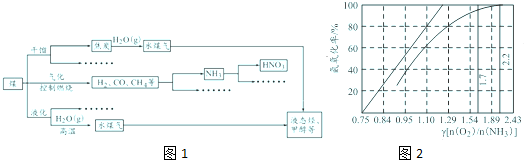
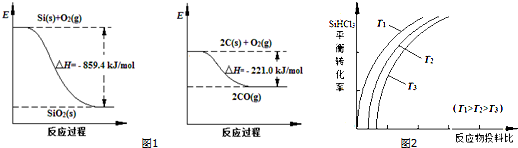
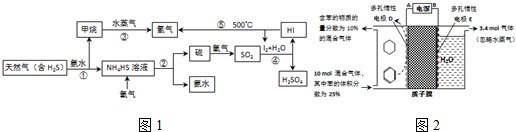
分析:(1)根据图1可知,O
2将NH
4HS中的S元素氧化为S单质,据此写出化学方程式;
(2)SO
2将I
2还原为HI,而I
2将SO
2氧化为H
2SO
4,据此写出离子方程式;
(3)①反应①是气体体积增大的吸热反应,一定可以提高平衡体系中H
2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大,依据平衡移动原理和影响反应速率因素分析判断;
②依据化学平衡三段式列式计算,转化率=
×100%计算;
③天然气中硫化氢的体积分数为5%,可得甲烷的体积,然后根据转化率为80%,结合化学方程式得出生成的氢气的体积;
(4)①该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
②阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答:
解:(1)根据图1可知,O
2将NH
4HS中的S元素氧化为S单质,S将氧气还原为-2价,根据得失电子数守恒将反应配平,得化学方程式:2NH
4HS+O
2═2NH
3?H
2O+2S↓,
故答案为:2NH
4HS+O
2═2NH
3?H
2O+2S↓;
(2)SO
2将I
2还原为HI,而I
2将SO
2氧化为H
2SO
4,故化学方程式为:SO
2+I
2+2H
2O═H
2SO
4+2HI,离子方程式为:SO
2+I
2+2H
2O═4H
++SO
42-+2I
-;
(3)①反应①CH
4(g)+H
2O(g)?CO
2(g)+3H
2(g)△H=+206.4 kJ?mol
-1,是气体体积增大的吸热反应,一定可以提高平衡体系中H
2百分含量,说明平衡正向进行,又能加快反应速率,说明影响反应速率的条件可以是升温、加压、增大浓度等,分析反应特征可知反应正向进行且反应速率增大的只有升温平衡向吸热反应进行,平衡正向进行反应速率增大;
a.反应是吸热反应,升高温度,反应速率增大,平衡正向进行,平衡体系中H
2百分含量增大,故a正确;
b.增大水蒸气浓度,平衡正向进行,反应速率增大,但平衡体系中H
2百分含量不一定增大,故b错误;
c.加入催化剂,改变反应速率不改变化学平衡,反应速率增大,氢气百分含量不变,故c错误;
d.降低压强,平衡向着正向移动,氢气百分含量减小,但反应速率减慢,故d错误;
故选a;
②利用反应②,将CO进一步转化,可提高H
2产量,若1mol CO和H
2的混合气体(CO的体积分数为20%)中 CO为0.2mol,H
2的物质的量为0.8mol,与H
2O反应,得到1.18mol CO、CO
2和H
2的混合气体,依据反应前后气体体积不变,增加的部分应该是起始的水蒸气的物质的量为0.18mol,设转化的一氧化碳的物质的量为x,
CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H=-41.2 kJ?mol
-1起始量(mol) 0.2 0.18+x 0 0.8
变化量(mol) x x x x
平衡量(mol)0.2-x 0.18 x x+0.8
则0.2-x+x+x+0.8=1.18
x=0.18
则CO转化率为
×100%=90%
故答案为:90%;
③天然气中硫化氢的体积分数为5%,故1.00m
3 天然气中甲烷的体积为0.95m
3 天然气,由于转化率为80%,设生成的氢气的体积为Xm
3,
可有:CH
4(g)+2H
2O(g)?CO
2(g)+4H
2(g)
1 4
0.95m
3×80% X
解得
=
解得X=3.04
故答案为:3.04;
(4)①该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C
6H
6+6H
++6e
-=C
6H
12,
故答案为:C
6H
6+6H
++6e
-=C
6H
12;
②阳极上氢氧根离子放电生成氧气,阳极上生成3.4mol氧气转移电子的物质的量=3.4mol×4=13.6mol,
生成1mol氧气时生成2mol氢气,则生成3.4mol氧气时同时生成6.8mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×25%-xmol,反应后苯的含量=
| 10mol×25%-X |
| 10mol-3Xmol+6.8mol |
×100%=10%,
x=1.17,苯转化为环己烷转移电子的物质的量为1.17mol×6=7.02mol,则
×100%=51.6%,
故答案为:51.6%.



 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案