
| A. | 标准状况下,11.2LHF中含有H-F键的数目为0.5NA | |
| B. | 常温下,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA |
分析 A、标况下HF为液态;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
C、铁常温下在浓硫酸中会钝化;
D、阳极生成的气体所处的状态不明确.
解答 解:A、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量和H-F键个数,故A错误;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故B正确;
C、铁常温下在浓硫酸中会钝化,反应程度很小,故生成的二氧化硫分子小于NA个,故C错误;
D、阳极生成的气体所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液导电性良好,所以氯气是强电解质 | |
| B. | NaCl溶液在电流作用下电离成Na+和Cl- | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 有单质参加的化学反应不一定都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗涤沉淀时,应用玻璃棒轻轻搅拌,使得沉淀表面上的杂质溶于水中 | |
| B. | 将两块未擦去氧化膜的铝片分别投入1mol?L-1CuSO4溶液、1mol?L-1CuCl2溶液中,一段时间后,铝片表面都观察不到明显的反应现象 | |
| C. | 由锌、铜、稀硫酸构成的原电池溶液中加入适量的H2O2能提高电池的放电效率 | |
| D. | 在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,若无砖红色沉淀产生,则淀粉未发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10 O (醇类) | B. | C3H6Cl(不饱和卤代烃) | ||
| C. | C4H8O2(酯类) | D. | C9H12(芳香烃) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5-3.2 | 6.4-8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色;乙醇使高锰酸钾溶液褪色 | |
| B. | 油脂的皂化反应;乙烯制乙醇 | |
| C. | 蔗糖水解;乙醇和乙酸制乙酸乙酯 | |
| D. | 苯制溴苯;苯和氢气制环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
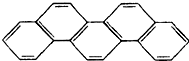 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )| A. | 该有机物属芳香烃 | |
| B. | 该物质属氨基酸 | |
| C. | 该物质分子中只含非极性键 | |
| D. | 该物质完全燃烧产生水的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com