
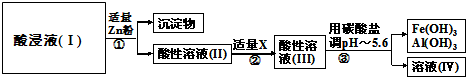
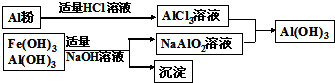

| 3n |
| 4 |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
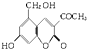 ,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测得氯水的pH值 |
| B、葡萄糖银镜反应实验后的试管内壁附有银,可用氨水清洗 |
| C、将AlCl3溶液蒸发结晶提取无水AlCl3 |
| D、欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
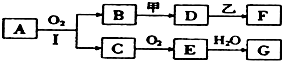
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴离子具有氧化性 |
| B、氯气是还原剂 |
| C、该反应属于复分解反应 |
| D、氯气的氧化性比溴单质强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com