
| A. | 标准状况下,2.24 L甲醛中含氧原子数目为0.1NA | |
| B. | 常温下,28g C2H4含NA个碳碳双键 | |
| C. | 常温常压下,1 mol羟基所含的电子数为9NA | |
| D. | 常温常压下,10 g 46%酒精水溶液中含氧原子总数为0.1NA |
分析 A、标况下甲醛为气体;
B、求出乙烯的物质的量,然后根据1mol乙烯中含1mol碳碳双键来分析;
C、羟基中含9个电子;
D、酒精水溶液中除了酒精含有氧原子,水也含氧原子.
解答 解:A、标况下甲醛为气体,故2.24L甲醛的物质的量为0.1mol,则含0.1NA个氧原子,故A正确;
B、28g乙烯的物质的量为1mol,而1mol乙烯中含1mol碳碳双键,故含NA个碳碳双键,故B正确;
C、羟基中含9个电子,故1mol-OH中含9NA个电子,故C正确;
D、酒精水溶液中除了酒精含有氧原子,水也含氧原子,故此溶液中含有的氧原子个数大于0.1NA个,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 用 HNO2溶液作导电性实验,灯光较暗,说明 HNO2是弱电解质 | |
| B. | NaCl 溶液和 CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 25℃时,用醋酸溶液中和等浓度 NaOH 溶液至 pH=7,VCH3COOH<VNaOH | |
| D. | AgCl 易转化为 AgI 沉淀且 Ksp(AgX)=[Ag+]•[X-],故 Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
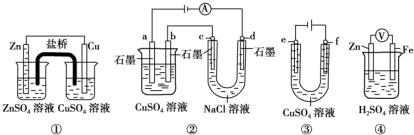
| A. | 装置①中,盐桥中的K+移向CuSO4溶液 | |
| B. | 装置②中b极析出6.4 g固体时,d极产生2.24 L H2 | |
| C. | 用装置③精炼铜时,f极为粗铜 | |
| D. | 装置④中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Na+、SO42-、Cl-、S2- | ||
| C. | NH4+、Mg2+、SO42-、NO3- | D. | H+、K+、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
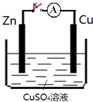
| A. | K打开,Zn片上会有金属铜析出 | |
| B. | 无论K是否闭合,锌片均会溶解,溶液均从蓝色逐渐变浅 | |
| C. | K闭合时,SO42-向铜电极移动 | |
| D. | K闭合时,电子从负极Zn流向正极 Cu,再从溶液中回到负极Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠(固体) | B. | 少量硫酸铜溶液 | C. | Na2SO4溶液 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期第ⅤA族 | B. | 第二周期第ⅤA族 | C. | 第三周期第ⅣA族 | D. | 第三周期第ⅤA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快反应 | B. | 升高温度能增大反应的速率 | ||
| C. | 改变压强对反应速率没有影响 | D. | 降低温度能加快反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
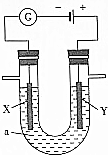 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com