
| A、在水中加入少量氯化钠,并加热到100℃ |
| B、在水中滴人稀硫酸 |
| C、在水中加入小苏打 |
| D、在水中加入氯化铝固体 |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
| A、镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 |
| B、用过量氨水除去Fe3+溶液中的少量Al3+ |
| C、Al(OH)3中混有少量Mg(OH)2:加入过量烧碱溶液充分反应,过滤,向滤液中通入过量CO2后过滤 |
| D、可以用过量氢氧化钠溶液除去MgO中的少量Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
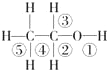
| A、和金属钠反应时键①断裂 |
| B、和氢溴酸反应时键①断裂 |
| C、和浓硫酸共热140℃时键①或键②断裂;170℃时键②⑤断裂 |
| D、在Ag催化下和O2反应键①③断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+3H2(g)?2NH3(g) |
| B、H2O(g)+C(s)?CO(g)+H2(g) |
| C、H2(g)+I2(g)?2HI(g) |
| D、2NO2(g)?N2O4(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应△H>0 |
| B、强电解溶液的导电能力一定强于弱电解质溶液的导电能力 |
| C、CH3COOH、Cu(OH)2、BaSO4、NH3都是常见的弱电解质 |
| D、常温下就能发生的化学反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸易挥发,而硫酸难挥发 |
| B、常温常压下,溴呈液态,碘呈固态 |
| C、稀有气体一般很难发生化学反应 |
| D、氮气的化学性质比氧气稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com