
【题目】工业生产玻璃会产生大量的窑炉气(含SO2和氮氧化物等).为减少环境污染,某工厂生产玻璃与处理窑炉气的工艺流程如下: 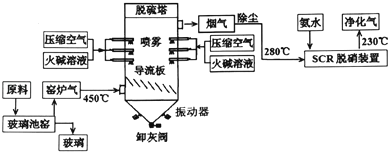
(1)生产普通硅酸盐玻璃的主要原料是石英砂、 和石灰石。其中,石灰石参与的反应方程式是 。
(2)窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,该反应方程式为 ;氮氧化物主要源于空气中N2与O2的反应,该类气体在高温下基本无色,随温度的降低逐渐偏向红棕色,原因是 。
(3)“脱硫塔”中反应形成的灰分,除亚硫酸钠和氮的含氧酸盐外,主要还有 ;用于喷雾的火碱溶液应选用软化水配制,原因是 。
(4)在“脱硝装置”中,催化剂设计成蜂窝而韭平板状结构.原因是 。氧气在脱硝过程中的作用是
(5)净化气的主要成分是 .
【答案】
(1)纯碱;SiO2 + CaCO3 ![]() CaSiO3 + CO2↑
CaSiO3 + CO2↑
(2)2Na2SO4 ![]() 2Na2O + 2SO2↑ + O2↑;NO与O2反应生成红棕色NO2 , 且该反应为放热反应
2Na2O + 2SO2↑ + O2↑;NO与O2反应生成红棕色NO2 , 且该反应为放热反应
(3) Na2CO3和Na2SO4;减少不溶或微溶盐的生成,避免堵塞喷头
(4)增大催化剂的表面积,加快反应速率;作为还原剂使氮氧化物转变为氮气
(5)N2和H2O
【解析】(1)生产玻璃的原料是纯碱、石英和石灰石,碳酸钙可以和二氧化硅之间发生反应生成硅酸钙和二氧化碳,反应方程式为:SiO2+CaCO3![]() CaSiO3+CO2↑, 所以答案是:纯碱;SiO2+CaCO3
CaSiO3+CO2↑, 所以答案是:纯碱;SiO2+CaCO3![]() CaSiO3+CO2↑;(2)窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,根据化合价变化可知还会生成氧气和氧化钠,该反应方程式为:2Na2SO4═2Na2O+2SO2↑+O2↑;氮氧化物主要源于空气中N2与O2的反应,该类气体在高温下基本无色,随温度的降低逐渐偏向红棕色,生成的气体为NO,NO与氧气反应生成二氧化氮,且该反应为放热反应,所以答案是:2Na2SO4═2Na2O+2SO2↑+O2↑;NO与O2反应生成红棕色NO2 , 且该反应为放热反应;(3)根据生成原理可知灰分中除亚硫酸钠和氮的含氧酸盐外,还含有Na2CO3和Na2SO4;减少不溶或微溶盐的生成,避免堵塞喷头,则用于喷雾的火碱溶液应选用软化水配制,所以答案是:Na2CO3和Na2SO4;减少不溶或微溶盐的生成,避免堵塞喷头;(4)在“脱硝装置”中,催化剂设计成蜂窝而非平板状结构,可增大催化剂的表面积,加快反应速率,所以答案是:增大催化剂的表面积,加快反应速率.
CaSiO3+CO2↑;(2)窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,根据化合价变化可知还会生成氧气和氧化钠,该反应方程式为:2Na2SO4═2Na2O+2SO2↑+O2↑;氮氧化物主要源于空气中N2与O2的反应,该类气体在高温下基本无色,随温度的降低逐渐偏向红棕色,生成的气体为NO,NO与氧气反应生成二氧化氮,且该反应为放热反应,所以答案是:2Na2SO4═2Na2O+2SO2↑+O2↑;NO与O2反应生成红棕色NO2 , 且该反应为放热反应;(3)根据生成原理可知灰分中除亚硫酸钠和氮的含氧酸盐外,还含有Na2CO3和Na2SO4;减少不溶或微溶盐的生成,避免堵塞喷头,则用于喷雾的火碱溶液应选用软化水配制,所以答案是:Na2CO3和Na2SO4;减少不溶或微溶盐的生成,避免堵塞喷头;(4)在“脱硝装置”中,催化剂设计成蜂窝而非平板状结构,可增大催化剂的表面积,加快反应速率,所以答案是:增大催化剂的表面积,加快反应速率.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C8H4O3)是化工中的重要原料,尤其用于增塑剂的制造.A与对苯二酚经脱水可合成1,4﹣二羟基蒽醌.以A和乙烯为原料,通过如下路线,可以合成塑化剂DBP. CH2=CH2![]() B
B ![]() C
C ![]() D(C4H10O)
D(C4H10O) ![]() DBP(C16H22O4)已知:①对苯二酚结构简式:
DBP(C16H22O4)已知:①对苯二酚结构简式: ![]() 1,4一二羟基蒽醌结构简式
1,4一二羟基蒽醌结构简式  ②
② 
回答下列问题:
(1)A的结构简式为 .
(2)C中不含氧官能团的名称为 .
(3)由B生成D的过程中,涉及的反应类型有(填序号).
a.取代反应 b.加成反应 c.消去反应 d.还原反应
(4)写出D与A反应合成DBP的化学方程式 .
(5)X是D的同分异构体,其1H核磁共振谱图中有2组峰.写出X的结构简式 .
(6)A与异辛醇( ![]() )反应可以制得另一种塑化剂DEHP.参照D的上述合成路线,设计一条由D为起始原料制备异辛醇的合成路线. .
)反应可以制得另一种塑化剂DEHP.参照D的上述合成路线,设计一条由D为起始原料制备异辛醇的合成路线. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于氨气“喷泉实验”(如图所示)的现象或结论的描述正确的是( ) 
A.烧杯中的水面会缓缓上升
B.烧瓶内形成蓝色喷泉
C.实验证明氨气极易溶于水
D.实验证明氨气的密度大于空气的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 铵盐化学性质都很稳定
B. 雷雨天气时空气中能生成少量的氮氧化物
C. 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
D. O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在医药、染料、香料等行业中都有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛,试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是?
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的是?
(3)实验过程中,可循环使用的物质有?
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是 , 其原理是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔奖.由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如下: 
己知氢化青蒿素的分子式为C15H22O4 . 回答下列问题:
(1)青蒿素的分子式为 .
(2)反应①中,NaBH4的作用是 .
A.氧化剂
B.还原剂
C.催化剂
D.溶剂
(3)有机物D的结构简式为 .
(4)青蒿琥酯能够发生的反应类型有 .
A.酯化化反应
B.水解反应
C.还原反应
D.加聚反应
(5)参照H2Q的表示方式,写出反应②的化学方程式 .
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E.合成过程中,有机原料除H2Q、 ![]() 外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
外,还需含苯环的二羟基化合物P,其结构简式为 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Be(OH)2是两性的,跟强酸反应时生成Be2+ , 跟强碱反应时生成BeO22﹣ . 现有三份等物质的量浓度、等体积的BeCl2、MgCl2、AlCl3溶液(配制时均加入少量盐酸),现将一定浓度的NaOH溶液分别滴入三种溶液中至过量,NaOH溶液的体积x(mL)与生成沉淀的物质的量y(mol)的关系如图所示,则与BeCl2、MgCl2、AlCl3三种溶液对应的图象正确的是( ) 
A.⑤③①
B.②③④
C.③⑤④
D.③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.
请回答下列问题:
(1)该“84消毒液”的物质的量浓度为molL﹣1 .
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(3)“84消毒液”可用氯气和氢氧化钠溶液反应制得,写出该反应的化学方程式: .
(4)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数37.25%的消毒液.
需要称量NaClO固体的质量为g.
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是(填选项字母).
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.有关说法正确的是( )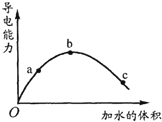
A.a、b、c三点溶液的pH:a>b>c
B.若使C点的 c(CH3COO-)增大,溶液的pH也增大,可加入适量的CH3COONa固体
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com