
【题目】常温下,向20mL 0.5mol·L-1的CH3COOH溶液中逐滴滴加0.5mol·L-1的NaOH溶液,滴定曲线如图。相关分析正确的是
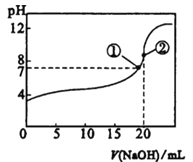
A. 滴加至①时,c(Na+)=c(CH3COO-),酸碱恰好完全反应
B. 滴加至②时,c(OH-)—c(H+) =c(CH3COOH)
C. 滴定中,c(CH3COO-)/c(H+)逐渐减小
D. 滴定中,c(CH3COOH)与c(CH3COO-)之和保持不变
科目:高中化学 来源: 题型:
【题目】工业上可用硫酸银与硫黄培烧制备氧化铝,再电解氧化铝,发生反应如下:反应Ⅰ:2A12(SO4)3+3S![]() 2Al2O3+9SO2↑
2Al2O3+9SO2↑
反应Ⅱ:2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
下列说法正确的是
A. 反应Ⅰ中S 单质是氧化剂
B. 反应Ⅱ中铝元素被氧化
C. 当生成5.4gAl时,反应Ⅰ和Ⅱ共转移1.2mole-
D. 反应Ⅰ中氧化产物与还原产物物质的量之比为2:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。现有下列两种制备ClO2的方法:
(1)方法一:可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因____________________________________。
(2)方法二:氯化钠电解法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②该法工艺原理示意图如图所示。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2,二氧化氯发生器中生成ClO2的化学方程式为_________________________________。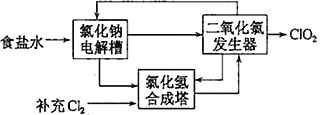
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①_____________________________________;②_______________________________________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.玻璃棒用作引流 b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:

(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为有色溶液),下层_____色。

Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH - 均存在。
(2)如何洗涤Mg(OH)2沉淀?___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应8NH3+3Cl2==6NH4Cl+N2,回答下列问题:
(1)当有34gNH3参加反应时,被氧化的物质的质量为_____ g,生成的还原产物的质量为_______g。
(2)在反应:K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O中,用氧化还原反应的知识____是氧化剂,_____是还原剂,用“双线桥法”表示反应中电子转移的方向和数目:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰和高分子树脂M的合成路线如图所示:
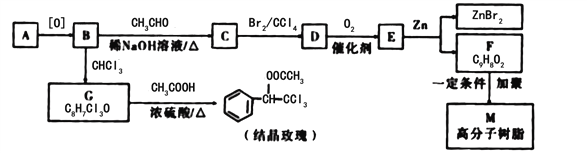
已知:①A是苯的同系物,在相同条件下,其蒸气相对于氢气的密度为46
②![]()
③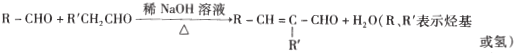
④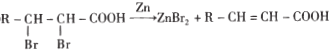
(1)C中含氧官能团的名称为______,E的结构简式为_____。
(2)写出由G生成结晶玫瑰的化学方程式________________________________。
(3)在上述流程中“C→D”在M的合成过程中的作用是___________________________
(4)己知G在一定条件下水解生成![]() ,写出H满足下列条件的同分异构体的结构简式______________________________
,写出H满足下列条件的同分异构体的结构简式______________________________
a与氯化铁溶液发生显色反应
b苯环上的一氯取代物只有一种
c与足量的氢氧化钠溶液反应,![]() 可消耗
可消耗![]() NaOH
NaOH
(5)E的同分异构体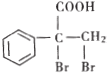 是一种重要的药物中间体,其合成路线与E相似,请以
是一种重要的药物中间体,其合成路线与E相似,请以![]() 为原料设计它的合成路线(其他所需原料自选)_______________.
为原料设计它的合成路线(其他所需原料自选)_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均呈黄色。
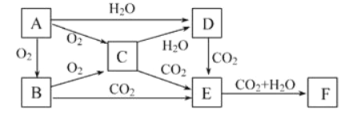
(1)写出下列物质的名称:B____________、E_____。
(2)写出E→F的离子方程式________________________。
F(固体)→E的化学方程式_____________。
(3)写出C与二氧化碳反应的化学方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤造成的S2的大量排放已经给我们的生存环境造成了严重破坏,科学研究发现:一定条件下,通过下列反应可实现燃煤烟气中硫的回收。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g) ![]() 2CO2(g)十S(l) △H=________ kJ/mol
2CO2(g)十S(l) △H=________ kJ/mol
(2)燃煤烟气中硫的回收反应的平衡常数表达式K=_________。在温度和容积不变时,下列说法正确的是_________ (填字母序号)
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是_________(填字母序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mo1/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为_____________;
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为_______________;总反应式为__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com