
【题目】等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1 H2SO4溶液
B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液
D.3 mol·L-1 HNO3溶液
科目:高中化学 来源: 题型:
【题目】在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属.三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出).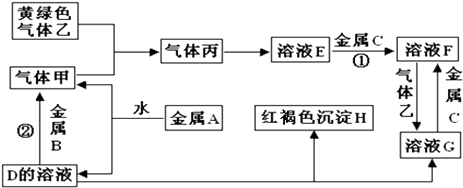
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A;H; G;乙;
(2)写出下列反应的化学方程式反应①反应② .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( ) 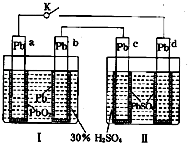
A.K闭合时,d电极反应式:PbSO4+2H2O﹣2e﹣=PbO2+4H++SO42﹣
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol
C.K闭合时,II中SO42﹣向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只含Cl![]() 、CO
、CO![]() 、SO
、SO![]() 、Na
、Na![]() 、K
、K![]() 、Mg
、Mg![]() 六种离子中的某几种。经实验:
六种离子中的某几种。经实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。回答下列问题:
(1)试分析原溶液中一定含有的离子是______________,一定不含有的离子是_______,可能含有的离子是______________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)_________,说明理由_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
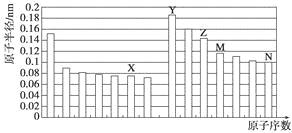
A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的沸点相比,前者较低
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质露置在空气中易变质的是( )
①漂白粉 ②苯酚 ③水玻璃 ④硫酸钠 ⑤烧碱⑥亚硫酸钠 ⑦胆矾 ⑧硬化油
A.除④⑦⑧外
B.除④⑦外
C.除⑥⑦⑧外
D.全部易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验Ⅰ:下图1为实验室制取氨的实验装置。

(1)写出A中所发生反应的化学方程式____________________________________。
(2)在收集氨时试管口棉花的作用是______________________________________。
(3)另一学生积极思考产生喷泉的其他方法,设计了图3装置。首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是(____)
A.CaCO3粉末和浓盐酸 B.NH4HCO3溶液与稀NaOH溶液
C.HCl和AgNO3溶液 D.HCl和酚酞溶液
(4)该同学又向锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是(____)
A.硝酸铵 B.食盐 C.浓硫酸
实验Ⅱ:为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
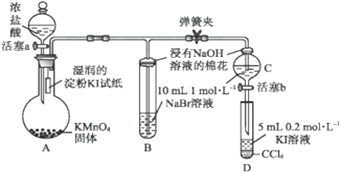
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为橙黄色时,夹紧弹簧夹。
Ⅲ.当B中橙黄色溶液颜色变深时,关闭活塞a。
Ⅳ. 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡。
(1)A中产生黄绿色气体,其化学方程式是__________________
(2)B中溶液发生反应的离子方程式是____________________
(3)过程Ⅳ的目的为______________________________________
(4)D中出现的现象为____________________________
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下_________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中.下列说法正确的是( ) 
A.外电路的电流方向是由a极流向b极
B.电池正极反应式为MnO2+e﹣=MnO ![]()
C.用稀硫酸代替有机溶剂,增加自由移动的离子浓度,可以增加电池的电流强度
D.Li+通过电解质迁移入MnO2晶格中,生成LiMnO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com