
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )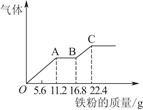
| A.原混合酸中NO物质的量浓度为2 mol/L |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol/L |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
某金属和硝酸反应,已知参加反应的被还原的硝酸和参加反应的硝酸的物质的量之比为1∶6,若已知还原产物唯一,则还原产物为
| A.N2 | B.N2O | C.NO | D.NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高温下焙烧CuFeS2的反应之一为:2CuFeS2+7O2 CuSO4+CuO+Fe2O3 +3SO2,
CuSO4+CuO+Fe2O3 +3SO2,
下列关于该反应的叙述正确的是
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是( )
| A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| B.加入NaOH溶液的体积是50mL |
| C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol |
| D.得到的金属氢氧化物的沉淀为3.12克 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
小明做实验时不小心粘了一些高锰酸钾,皮肤上出现了难看的黑斑,老师告诉他可以用草酸的稀溶液进行清洗,其反应的离子方程式为:
MnO4—+H2C2O4+H+—— CO2↑+Mn2++ (未配平),下列说法中正确的是 (填字母)。
| A.该反应的氧化剂为H2C2O4 |
| B.该反应右边横线上的产物为OH- |
| C.该反应配平后H+的化学计量数为6 |
| D.在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O72—+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
| A.10 | B.12 | C.14 | D.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
BaSO4(s)+4C(s)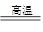 4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)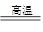 2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
下列说法不正确的是( )
| A.上述反应中BaSO4均作氧化剂 |
B.反应C(g)+CO2(g)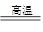 2CO(g)的ΔH3>+172.5 kJ·mol-1 2CO(g)的ΔH3>+172.5 kJ·mol-1 |
| C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 |
| D.以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )。
| A.反应后溶液中c(NO3-)=0.85 mol·L-1 |
| B.反应后的溶液最多还能溶解1.82 g Fe |
| C.反应前HNO3溶液的浓度为1.0 mol·L-1 |
| D.1.12 L气体是NO、NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
①2Na2O2+2H2O=4NaOH+O2↑
②4Fe(OH)2+O2+2H2O=4Fe(OH)3
③2F2+2H2O=4HF+O2
④2Al+2NaOH+2H2O=2NaAlO2+3H2↑
| A.①② | B.②③ | C.①③ | D.③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com