


科目:高中化学 来源: 题型:
| A、一个D2O分子所含的中子数为8 |
B、NH3的结构式为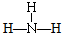 |
C、HCl的电子式为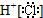 |
| D、热稳定性:H2S>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3 | K1=4×10-7 K2=6×10-11 |
| A、向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O=2Cl-+2HClO+CO2↑ |
| B、向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2=Cl-+ClO-+2CO2↑+H2O |
| C、向NaClO溶液中通少量CO2:CO2+NaClO+H2O=NaHCO3+HClO |
| D、向NaClO溶液中通过量CO2:CO2+2NaClO+H2O=Na2CO3+2HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入2滴含[Fe(CN)6]3-溶液,出现蓝色沉淀. | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体是NH3 |
| D | 将少量某有机物滴加到新制氢氧化铜中,充分振荡,未见砖红色沉淀生成 | 该有机物不含醛基 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
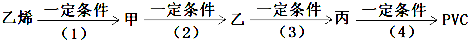
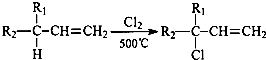
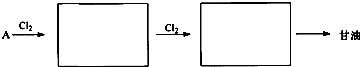
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(S2-)>c(HS-)>c(OH-)>c(H+) |
| B、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| C、c(Na+)+c(H+)>c(HS-)+c(S2-)+c(OH-) |
| D、3c(S2-)+3c(HS-)+3c(H2S)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、适当加热 |
| B、适量加NaOH. |
| C、适量加盐酸 |
| D、适量加KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
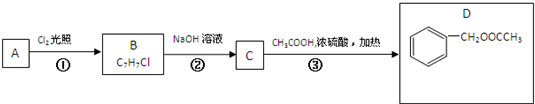
 基团的同分异构体有
基团的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
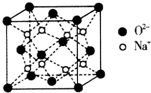 H、C、N、O、Na、Fe、Cu是常见的七种元素.
H、C、N、O、Na、Fe、Cu是常见的七种元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com