
【题目】据报道,以NaBH4和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是
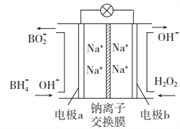
A. 该电池的总反应为NaBH4 + 4H2O2=NaBO2 + 6H2O
B. 电池放电时Na+从b极区移向a极区
C. 每消耗1mol H2O2,转移的Na+的物质的量为2mol
D. 纳米MnO2层的作用是提高原电池的工作效率
科目:高中化学 来源: 题型:
【题目】将13.6 g带铁锈的铁片溶解于25 mL、14 mol/L的热的浓硫酸中,气体只有SO2且体积为1.12 L(标准状况)。将溶液稀释至100 mL,所得溶液遇KSCN溶液时无血红色出现。下列结论正确的是
A.反应中:转移电子3.01×1022个 B.反应后:剩余硫酸0.30 mol
C.原混合物:n(Fe2O3)∶n(Fe)=1∶2 D.所得溶液:c(FeSO4)=1.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的叙述错误的是
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.向容量瓶中转移液体时,引流用的玻璃棒可以接触容量瓶内壁
C.配制5%NaCl溶液时,必须用到的玻璃仪器是容量瓶、烧杯、胶头滴管、玻璃棒
D.分液漏斗、容量瓶及滴定管使用前都必须检漏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下RO3—与R—发生如下反应:RO3—+5R—+6 H+=3R2+3H2O,则下列关于R元素的说法中正确的是:( )
A. R位于元素周期表中的第VA族 B. R的氢化物的水溶液呈酸性
C. RO3—中的R元素只能被还原 D. R2在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料。利用CO2和 H2在催化剂的作用下合成甲醇,有关反应的反应热与平衡常数表示如下:
反应1:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1 K1
CO(g)+H2O(g) △H1 K1
反应2:CO(g)+2H2(g) ![]() CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
总反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3 K3
CH3OH(g)+H2O(g) △H3 K3
(1)①△H3=_________(用△H1、△H2表示)。
②K3 =____________(用K1、K2表示)。
③在恒温恒容的密闭容器中,能判断总反应达平衡状态的依据是______(填番号)。
a.容器中的压强保持不变
b.H2的质量分数保持不变
c.有两个C=O键断裂的同时水分子中有两个H-O键断裂
d.化学平衡常数K保持不变
e.c(CO2) =c(H2O)
f.速率v (CO2) =v(H2O)
④在某温度下,反应体系达平衡时,增大体系的压强,体系中,反应1的平衡______移动(填“向正反应方向”、“向逆反应方向”和“不”)。
(2)以上平衡常数随温度变化的曲线如图所示:
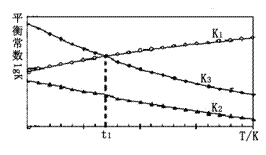
①则△H2_____△H3(填“大于”、“小于”或“等于”),理由是______________。
②温度为t1时,体系建立起化学平衡状态,测得c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)=________。
(3)甲醇可用于制取氰化氢。已知:Ka(HCN) = 6.0×10-10,Kw=1×10-14氰化钠水解的离子方程式为CN-+H2O![]() HCN+OH-。
HCN+OH-。
①该水解反的平衡常数的值Kh=_________。
②一种由等物质的量浓度的NaCN和HCN组成的缓冲溶液,该溶液的pH____7 (“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
a.98%的浓硫酸 b.1%的品红溶液 c.1.0 mol·L-1的KI-淀粉溶液
d.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为_______mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,只含有下表中所示的四种离子(忽略水的电离),则X离子及其个数b可能为

A.NO3-、4a B.OH-、8a C.SO42-、4a D.SO42-、8a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com